GIMDOS KAKLELIO VĖŽIO PATIKROS PROGRAMOS
KOKYBĖS UŽTIKRINIMO REIKALAVIMAI
Kaunas, 2021
Turinys
SĄVOKOS................................................................................................................................. 8
SANTRUMPOS....................................................................................................................... 10
ĮVADAS................................................................................................................................... 12
I SKYRIUS. EPIDEMIOLOGIJA IR GIMDOS KAKLELIO VĖŽIO PATIKROS PROGRAMOS VALDYMAS................................................................................................................................ 13
1.1. Gimdos kaklelio vėžio patikros programos valdymo pagrindiniai principai................ 13
1.1.1. Gimdos kaklelio vėžio epidemiologinė situacija Lietuvoje....................................... 13
1.1.4. Gimdos kaklelio vėžio patikros programos organizacinė struktūra........................... 16
1.1.4.1. Gimdos kaklelio vėžio patikros programos regioninių koordinavimo centrų atsakomybė, veikla ir funkcijos.................................................................................................................................... 17
II Skyrius. GIMDOS KAKLELIO VĖŽIO PATIKROS PROGRAMOS KOKYBĖS UŽTIKRINIMAS....................................................................................................................................................... 22
2.2. Gimdos kaklelio vėžio patikros programos kokybės kontrolės sistema (reikalavimai ir standartai)................................................................................................................................................... 22
2.3. Gimdos kaklelio vėžio patikros programos pakvietimo proceso pagrindiniai kokybės principai................................................................................................................................................... 31
2.3.2. Kvietimo į patikros programą tvarkaraščių, formos ir turinio metodai, principai ir užduotys................................................................................................................................................... 33
2.3.3. Komunikacijos su ištirtomis moterimis po pirminio citologinio ar ŽPV tyrimo principai (atrankos ir informavimo principai, forma ir turinys)............................................................................... 40
2.3.4. Grįžtamojo ryšio su specialistų ištirtomis moterimis principai.................................. 40
2.4. Oportunistinio pasitikrinimo apibūdinimas................................................................... 41
2.6. Atlikto profilaktinio tyrimo (citologinio ar ŽPV) rezultatų registravimo (laboratorijoje) formos ir turinio principai......................................................................................................................... 41
2.7. Gimdos kaklelio vėžio patikros programos vykdymo kokybės stebėsena ir vertinimas. 42
2.7.1. Kvietimo patikros intensyvumo kokybės rodikliai.................................................... 42
2.7.2. Patikros tyrimų atlikimo kokybės rodikliai................................................................ 44
2.7.3. Testo specifiškumo kokybės rodikliai........................................................................ 46
2.7.4. Diagnostinio įvertinimo ir gydymo kokybės rodikliai............................................... 48
2.7.5. Kokybės rodikliai pirminės asmens sveikatos priežiūros grandyje............................ 50
2.8. GKV PP duomenų šaltiniai........................................................................................... 53
2.8.1. Gyventojų registro ir Gyventojų migracijos informacinės sistemos.......................... 53
2.8.2. ASPĮ ir laboratorijų (LIS) informacinės sistemos...................................................... 54
2.8.3. Informacinė sistema „E. sveikata“ (ESPBI IS).......................................................... 55
2.8.4. Kviečiamų ir dalyvavusių patikros programoje tiriamųjų informacinė sistema (ESPBI IS/GKV PP posistemė).................................................................................................................................. 55
2.8.5. Vėžio registro informacinė sistema............................................................................ 56
2.8.6. Mirties priežasčių registro informacinė sistema......................................................... 57
2.9. GKV PP gautų duomenų saugojimo ir archyvavimo principai..................................... 57
III SKYRIUS. PROGRAMOS ĮGYVENDINIMAS PIRMINĖs ASMENS SVEIKATOS PRIEŽIŪROS GRANDYJE.................................................................................................................................. 75
3. PASPC taikomi kokybės užtikrinimo reikalavimai ir rodikliai........................................ 75
3.1. Organizaciniai reikalavimai.......................................................................................... 75
3.2. Personalo kvalifikacijos reikalavimai........................................................................... 75
3.3. Reikalavimai, taikomi įrangai, aplinkai ir priemonėms................................................ 75
3.4. Tyrimo mėginio ėmimo reikalavimai............................................................................ 76
3.4.1. Citologinio tyrimo mėginio ėmimas........................................................................... 77
3.4.1.1. Citologinio tyrimo tepinėlio paėmimas endocervikaline šluotele........................... 77
3.5. Tyrimo duomenų registravimas..................................................................................... 78
3.6. Komunikacija su moterimi............................................................................................ 79
IV SKYRIUS. CITOLOGINIŲ TYRIMŲ KOKYBĖS UŽTIKRINIMAS............................. 82
4.1. Laboratorijos organizaciniai citologinių tyrimų kokybės reikalavimai........................ 82
4.1.1. Reikalavimai, taikomi citologijos laboratorijų patalpoms ir įrangai.......................... 82
4.1.2. Personalo kokybinės kvalifikacijos............................................................................ 83
4.1.3. Personalo kvalifikacija ir kompetencija..................................................................... 83
4.1.4. Mėginių priėmimas ir jų kokybės įvertinimas............................................................ 85
4.1.5. Mėginio registracija ir pranešimas apie patikrą......................................................... 85
4.1.6. Citologinio mėginio ruošimas mikroskopuoti laboratorijoje..................................... 85
4.1.7. Citologinio mėginio mikroskopavimas...................................................................... 85
4.1.8. Rezultatų įvertinimas ir pateikimas............................................................................ 88
4.1.10. Atitikčiai kokybės rodikliams ir standartams vertinti reikalingų duomenų registravimas................................................................................................................................................... 88
4.1.11. Vidinė kokybės kontrolė........................................................................................... 89
V SKYRIUS. ŽPV TYRIMo KOKYBĖS UŽTIKRINIMAS LABORATORIJOJE............... 91
5.1. ŽPV tyrimo kokybės reikalavimai ir standartai............................................................ 91
5.2. Organizaciniai reikalavimai.......................................................................................... 91
5.2.1. Laboratorijos licencijavimas ir akreditavimas........................................................... 91
5.2.2. Laboratorijoje atliekamų tyrimų apimtis.................................................................... 91
5.2.3. Darbuotojų sveikatos ir saugos reikalavimų laikymasis............................................ 91
5.2.4. Kokybės vadybos sistema........................................................................................... 91
5.3. Laboratorijos patalpoms taikomi reikalavimai.............................................................. 93
5.4. Personalo kvalifikacijos reikalavimai........................................................................... 94
5.5. Ėminių gabenimas, priėmimas, kokybės įvertinimas.................................................... 96
5.5.1. Ėminių gabenimas...................................................................................................... 96
5.6. Ėminių registravimas ir pranešimas apie GKV PP patikrinimą.................................... 96
5.7. ŽPV nustatymas............................................................................................................. 97
5.7.1. Reikalavimai ŽPV nustatymo metodui...................................................................... 97
5.8. Tyrimo rezultatų įvertinimas ir patvirtinimas............................................................... 97
5.9. Tyrimo rezultatų valdymas............................................................................................ 98
5.10. Saugojimas ir archyvavimas (ėminių, užsakymų, rezultatų ir kt.).............................. 98
5.11. Kokybės užtikrinimas ir gerinimas (vidinė ir išorinė kokybės kontrolė).................... 99
5.11.1. Vidinė kokybė kontrolė............................................................................................ 99
VI SKYRIUS. HISTOLOGINIS TYRIMAS IR JO KOKYBĖS UŽTIKRINIMAS LABORATORIJOJE..................................................................................................................................................... 101
6.1. Įžanga.......................................................................................................................... 101
6.2. Histologinio tyrimo kokybės reikalavimai ir standartai.............................................. 101
6.2.1. Organizaciniai reikalavimai..................................................................................... 101
6.2.2. Laboratorijos įrangos kokybės reikalavimai............................................................ 102
6.2.3. Personalo kokybės reikalavimai............................................................................... 102
6.2.4. Ėminio priėmimas, registracija ir pranešimas apie tyrimą....................................... 102
6.2.5. Makroskopinis vertinimas........................................................................................ 103
6.2.6. Ėminio paruošimas ir įliejimas................................................................................. 103
6.2.7. Ėminio parafininių blokų pjovimas.......................................................................... 104
6.2.8. Histologinio tyrimo mėginių dažymas..................................................................... 104
6.2.9. Mikroskopavimas ir rezultatų pateikimas................................................................ 104
6.2.10. Archyvavimas......................................................................................................... 104
6.2.11. Kokybės užtikrinimas ir nuolatinis tobulinimas..................................................... 105
VII SKYRIUS. DIAGNOSTINIS IŠTYRIMAS KOLPOSKOPIJOS METODU................. 107
7.1. Įžanga.......................................................................................................................... 107
7.2. Kolposkopijos kokybės reikalavimai ir standartai...................................................... 107
7.2.1. Organizaciniai reikalavimai..................................................................................... 107
7.2.1.1. Kvietimas atlikti tyrimo ir laukimo laiko standartai............................................. 107
7.2.1.2. Informavimo apie kolposkopijos rezultatus standartai ......................................... 108
7.3. Patalpoms ir įrangai taikomi reikalavimai................................................................... 108
7.4. Personalo kvalifikacijos reikalavimai.......................................................................... 109
7.4.1. Tyrimą atliekančio gydytojo kvalifikacijos reikalavimai......................................... 109
7.5. Duomenų registravimas, protokolai............................................................................ 109
7.6. Kolposkopinio tyrimo kokybės vertinimas................................................................. 109
7.6.1. Kolposkopinio tyrimo atlikimo standartai................................................................ 109
7.6.1.1. Kolposkopinio tyrimo indikacijos......................................................................... 110
7.6.1.2. Kolposkopinio tyrimo kontraindikacijos............................................................... 110
7.6.1.3. Kolposkopinio tyrimo sukeliamos komplikacijos................................................. 110
7.6.1.4. Infomatyvus kolposkopinis tyrimas...................................................................... 110
7. 6.2. Kolposkopinio tyrimo vertinimo standartai............................................................ 111
7.6.2.1. Transformacijos zona............................................................................................ 111
7.6.2.2. Transformacijos zonos klasifikacija...................................................................... 111
7.6.2.3. Kolposkopijos atlikimo technika........................................................................... 112
7.6.2.4. Kolposkopinio tyrimo vertinimas.......................................................................... 113
7.6.2.5. Kolposkopinių vaizdų analizė............................................................................... 113
7.6.2.5.1. Gimdos kaklelio kolposkopija po menopauzės.................................................. 115
7.6.3. Pagalbiniai kolposkopinio tyrimo instrumentai ir priemonės .................................. 115
7.6.3.1. Kolposkopui taikomi reikalavimai........................................................................ 115
7.6.4. Atliktų tyrimų mėginių saugojimas ir ištyrimas....................................................... 116
7.6.5. Kolposkopinio tyrimo auditas................................................................................... 116
7.6.6. Atliktų tyrimų rezultatų valdymas ........................................................................... 116
7.6.7. Tikslinė gimdos kaklelio biopsija............................................................................. 117
7.6.8. Endocervikalinis kiuretažas...................................................................................... 117
Privalomi reikalavimai ir standartai:.................................................................................. 117
VII SKYRIAUS PRIEDAI..................................................................................................... 118
Kolposkopijos aprašas............................................................................................................ 118
Kolposkopijos TYRIMAS...................................................................................................... 120
VIII SKYRIUS. TAKTIKA NUSTAČIUS POKYČIŲ......................................................... 121
8.1. Gimdos kaklelio vėžio patikros programos valdymo taktika nustačius patologiją..... 121
8.1.1. Terminai ir siuntimo standartai aptikus vėžį............................................................ 121
8.1.2. Citologinių tyrimų aprašų prieinamumas................................................................. 121
8.1.3. Netinkami mėginiai.................................................................................................. 121
8.1.4. Neigiami rezultatai................................................................................................... 121
8.1.6. Nežymūs plokščialąsteliniai intraepiteliniai pokyčiai (žemo laipsnio pokyčiai) (LSIL)................................................................................................................................................. 122
8.1.7. Žymūs plokščialąsteliniai intraepiteliniai pokyčiai (aukšto laipsnio pokyčiai) (HSIL, ASC-H)................................................................................................................................................. 122
8.1.8. Invazinė plokščiųjų ląstelių karcinoma.................................................................... 122
8.1.9. Liaukinė neoplazija.................................................................................................. 122
8.1.10. Neaiškūs atvejai...................................................................................................... 123
8.1.12. Patologiškai pakitęs kaklelis.................................................................................. 123
8.2. Rekomendacijos, taikytinos histologiškai patvirtinus gimdos kaklelio displaziją (CIN) (ES)................................................................................................................................................. 123
8.2.1. Taktika nustačius LSIL (CIN1)................................................................................ 123
8.2.2. Taktika nustačius HSIL (CIN2, CIN3) ir CIS.......................................................... 124
8.2.3. Mikroinvazinė karcinoma......................................................................................... 124
8.2.4. Stebėjimas po CIN gydymo...................................................................................... 124
8.3. Kitos klinikinės situacijos............................................................................................ 125
8.3.1. Nėščios moterys........................................................................................................ 125
8.3.2. Taktika diagnozavus CIN po menopauzės............................................................... 125
8.3.3. Taktika po histerektomijos, kai anksčiau buvo aptikta CIN.................................... 125
8.3.4. Pacientės, kurioms taikomas imunosupresinis gydymas.......................................... 126
8.3.5. ŽIV infekuotos moterys............................................................................................ 126
8.3.6. Taktika esant citologinio tyrimo ir kolposkopijos (histologinio tyrimo) rezultatų neatitikimų................................................................................................................................................. 126
8.4. Komunikacija su moterimis (informacijos pateikimas).............................................. 127
8.5. Kokybės reikalavimai ir standartai.............................................................................. 127
8.5.1. Personalo kvalifikacijos reikalavimai...................................................................... 127
8.5.2. Reikalingų duomenų registravimas, protokolai........................................................ 127
IX SKYRIUS. HISTOLOGINIU TYRIMU PATVIRTINTŲ POKYČIŲ CHIRURGINIS GYDYMAS..................................................................................................................................................... 128
9.1. Įžanga.......................................................................................................................... 128
9.2. Organizaciniai reikalavimai........................................................................................ 128
9.3. Patalpoms taikomi reikalavimai.................................................................................. 128
9.4. Personalo kvalifikacijos reikalavimai......................................................................... 128
9.5. Naudojamai įrangai taikomi reikalavimai................................................................... 128
9.6. Chirurginių metodų apžvalga...................................................................................... 129
9.6.1. Destrukciniai gydymo metodai................................................................................. 129
9.6.1.1. Krioterapija............................................................................................................ 129
9.6.1.2. Šaltoji koaguliacija................................................................................................ 130
9.6.2. Eksciziniai gydymo metodai.................................................................................... 130
9.6.2.1. Išpjovimas elektros kilpa....................................................................................... 131
9.6.2.2. Išpjovimas skalpeliu.............................................................................................. 132
SĄVOKOS
Citologinis tepinėlis – citologinis gimdos kaklelio tyrimas, atliekamas naudojantis Papanicolaou metodu (angl. Pap smear) ir padedantis nustatyti ikivėžinius ir vėžinius gimdos kaklelio ląstelių pokyčius.
Ekscizija – chirurginis pažaidos pašalinimas. Ekscizija leidžia histologiškai įvertinti pašalintos transformacijos zonos dalies pokyčius, jų specifiką bei atliekama nedelsiant, jei yra aukšto laipsnio intraepitelinė neoplazija arba įtariama ankstyvoji stromos invazija ar mikroinvazija.
Endocervikalinis kiuretažas – endocervikalinės pažaidos aptikimui skirta procedūra, kai pažaidos neįmanoma pasiekti atliekant kolposkopinę biopsiją. Procedūros metu naudojama kiuretė tam, kad iš gimdos kaklelio kanalo paimtas audinys būtų ištirtas mikroskopu.
Histerektomija – chirurginis gimdos pašalinimas.
ISO 15189:2012 standartas – bendrieji vertinimo ir akreditavimo reikalavimai, skirti akredituotoms arba siekiančioms akreditavimo medicinos laboratorijoms.
Klaidingai neigiamas mėginys – mėginys, kuriame nerandama intraepitelinių pokyčių, tačiau histologiniu tyrimu nustatoma reikšmingų intraepitelinių pokyčių.
Klaidingai teigiamas mėginys – mėginys, kuriame randama intraepitelinių pokyčių, tačiau histologiniu tyrimu pokyčių nenustatoma.
Kokybės reikalavimai – tai reikalavimai, pateikti užtikrinti kokybinius tam tikros veiklos ar proceso ypatumus kokybės atžvilgiu juos pateikiant aprašymu ir kurie neturi išmatuojamų tikslų kaip tam tikros paslaugos turi būti teikiamos.
Krioterapija – gydymo metodas, kai šalčiu sukeliama gimdos kaklelio transformacijos zonos audinių nekrozė.
Kviečiamos moterys – moterys, kurioms suėjo 25 metai iki kol sueina 60 metų (59 metų imtinai); dar nedalyvavusios programoje, kviestos dalyvauti programoje prieš 3 arba 5 metus, bet kurios nedalyvavo GKV PP arba dalyvavo programoje prieš daugiau negu 3 arba 5 metus (buvo atliktas įprastinis citologinis arba žmogaus papilomos viruso tyrimas). Kviečiamos moterys atrenkamos ir pakviečiamos kasmet (papildomi kviečiamų moterų kriterijai aprašyti 2.3.1. dalyje).
Kvietimas – kvietimas dalyvauti gimdos kaklelio vėžio patikros programoje.
Lazerinė vaporizacija – gydymo metodas, kai transformacijos zonos audiniai naudojant lazerį.
Mirties atvejų ir jų priežasčių valstybės registras – tvarkomi konfidencialūs duomenys apie mirusius asmenis: mirusiojo vardas ir pavardė, mirusiojo asmens kodas, mirusiojo gyvenamoji vieta. Registro tvarkytojas – Higienos institutas, duomenis tvarkantis Registro nuostatų nustatyta tvarka.
Mirtingumas nuo gimdos kaklelio vėžio – mirčių nuo gimdos kaklelio vėžio skaičius tam tikroje populiacijoje tam tikru laikotarpiu (išreiškiamas mirčių skaičiumi 100 000 gyventojų per metus).
Moterų atranka – tikslinės populiacijos moterų nustatymas ir asmeniškas kvietimas dalyvauti patikros tyrime.
Neigiamas prognozinis rodiklis – tikimybė, kad moteris sveika, jei patikros tyrimas yra neigiamas, t.y. sveikų moterų, kurių tyrimas neigiamas, ir visų tirtų moterų, kurių tyrimas neigiamas, santykis.
Neinformatyvus mėginys – mėginys, neatitinkantis informatyvumo kriterijų pagal Bethesdos klasifikaciją.
Oportunistinis tyrimas – patikra, atliekama ne pagal atrankinės patikros programą, t.y. pacientei kreipiantis dėl tyrimo savarankiškai arba atvykus į gydytojo konsultaciją ir jam rekomendavus ar paskyrus.
Rodiklis – tai išmatuojamas tam tikros veiklos (programos) vykdymo ar rezultatų kiekybinis ar kokybinis įvertis, naudojamas stebėti ir įvertinti tam tikros veiklos (programos) efektyvumą.
Pakartotinis kvietimas – kvietimas dalyvauti programoje, siunčiamas kas 3 arba 5 metus.
Patikros intervalas – fiksuotas 3 arba 5 metų intervalas tarp planinių patikrinimų.
Patikros tyrimas – pirminis tyrimas, atliekamas vykdant gimdos kaklelio vėžio patikros programą (profilaktinis įprastinis citologinis arba ŽPV tyrimas).
Sergamumas gimdos kaklelio vėžiu – naujai diagnozuotų gimdos kaklelio vėžio atvejų skaičius tam tikroje populiacijoje tam tikru laikotarpiu (išreiškiamas atvejų skaičiumi 100 000 gyventojų per metus).
Standartas – tai tam tikros veiklos aprašymas, turintis išmatuojamus tikslus, kurie turi būti pasiekti.
Standartizuotas mirtingumo rodiklis – mirčių nuo vėžio skaičius, apskaičiuotas taikant tiesioginės standartizacijos metodą Pasaulio standartinei populiacijai.
Standartizuotas sergamumo rodiklis – naujai diagnozuotų vėžio atvejų skaičius, apskaičiuotas taikant tiesioginės standartizacijos metodą Pasaulio standartinei populiacijai.
Šaltoji koaguliacija – tai procedūra, atliekama moterims, kurių gimdos kaklelyje yra pakitusių ląstelių, kai transformacijos zonos audiniai koaguliuojami iki 100°C įkaitintu antgaliu.
Teigiamas prognozinis rodiklis – tikimybė, kad moteris serga, jei patikros tyrimas yra teigiamas, t.y. sergančių moterų, kurių tyrimas teigiamas, ir visų tirtų moterų, kurių tyrimas teigiamas, santykis.
Tyrimo jautrumas – moterų, kurių atrankinės patikros rezultatai teigiami, dalis tarp sergančių moterų, dalyvavusių atrankinėje patikroje.
Tyrimo specifiškumas – moterų, kurių atrankinės patikros rezultatai neigiami, dalis tarp moterų, dalyvavusių atrankinėje patikroje ir nesergančių moterų.
Tolesnė stebėsena – reikiamos asmens sveikatos priežiūros užtikrinimas, atsižvelgiant į taikytas diagnostikos procedūras, patvirtintas diagnozes, gydymą.
Tolesni tyrimai nustačius pakitimus – papildomi diagnostiniai veiksmai (pakartotinis citologinis tepinėlis, ŽPV tyrimas, kolposkopija, histologinis tyrimas), atliekami siekiant išsiaiškinti atrankinės patikros tyrimu nustatyto pakitimo pobūdį.
Vaporizacija lazeriu – abliacinė procedūra gimdos kaklelio neoplazijai gydyti, naudojant didelės galios CO2 lazerį.
Vėžio registras – registruojami susirgimai onkologinėmis ligomis visoje Lietuvos teritorijoje. Registro tvarkytojas – Nacionalinis vėžio institutas, oficialią veiklą vykdantis vadovaujantis 2016 m. Lietuvos Respublikos Vyriausybės nutarimu.
Žmogaus papilomos viruso (ŽPV) tyrimas – plonasluoksnės skystosios citologijos metodu atliekamas tyrimas, skirtas nustatyti aukštos rizikos žmogaus papilomos viruso tipus, galinčius sukelti gimdos kaklelio ikivėžines ir vėžines būkles.
SANTRUMPOS
AGC – atipinės liaukinės ląstelės
AR ŽPV – aukštos rizikos žmogaus papilomos virusas
ASC-H – galimi žymūs plokščialąsteliniai intraepiteliniai pokyčiai
ASC-US – nenustatytos reikšmės (kilmės) atipinės plokščiojo epitelio ląstelės
ASPĮ – asmens sveikatos priežiūros įstaiga
CAP – Amerikos patologų kolegija (angl. College of American Pathologists)
CGIN – gimdos kaklelio liaukinė intraepitelinė neoplazija
CIN1 – nežymi, žemo laipsnio displazija
CIN2 – vidutinio laipsnio displazija
CIN3 – žymi, aukšto laipsnio displazija
CIS – carcinoma in situ
CLSI – Klinikinių ir laboratorijos standartų institutas (angl. Clinical and Laboratory Standards Institute)
CT – citologinis tyrimas
DNR – deoksiribonukleorūgštis
DDK – daugiadalykis konsiliumas
ECC – endocervikalinis kiuretažas (gimdos kaklelio kanalo išgramdymas)
EFLM – Europos klinikinės chemijos ir laboratorinės medicinos federacija (angl. European Federation of Clinical Chemistry and Laboratory Medicine)
EQALM – Europos organizacijų, teikiančių išorinio kokybės vertinimo paslaugas laboratorinei medicinai, grupė (angl. European group of organisations involved in the external quality assessment of laboratory medicine)
ESPBI IS – elektroninės sveikatos paslaugų ir bendradarbiavimo infrastruktūros informacinės sistemos
FDA – JAV maisto ir vaistų administracija (angl. Food and Drug Administration)
GKV – gimdos kaklelio vėžys
GKV PP – gimdos kaklelio vėžio patikros programa
GKV PP KC – Gimdos kaklelio vėžio patikros programos koordinavimo centras
GKV PP KK – Gimdos kaklelio vėžio patikros programos koordinavimo komitetas
GKV PP MC – Gimdos kaklelio vėžio patikros programos metodinis centras
GKV PP RC – Gimdos kaklelio vėžio patikros programos regioninis centras
GRT – Gyventojų registro tarnyba
HI – Higienos institutas
HSIL – žymūs plokščialąsteliniai intraepiteliniai pokyčiai (aukšto laipsnio pokyčiai)
IFCC – Tarptautinė klinikinės chemijos ir laboratorinės medicinos federacija (angl. International Federation of Clinical Chemistry and Laboratory Medicine)
IKV – išorinis kokybės vertinimas
IPPN – intraepitelinių ląstelių pakitimų nebuvimas
IPR – išankstinė pacientų registracija
KPK – klinikinės patologijos konferencija
KVS – kokybės vadybos sistema
LIS – laboratorijos informacinė sistema
LR – Lietuvos Respublika
LSIL – nežymūs plokščialąsteliniai intraepiteliniai pokyčiai (žemo laipsnio pokyčiai)
LSMU STI – Lietuvos sveikatos mokslų universiteto Sveikatos tyrimų institutas
LSMUL KK – Lietuvos sveikatos mokslų universiteto ligoninė Kauno klinikos (Vidurio ir Vakarų koordinavimo centras)
MD – Migracijos departamentas
MPR – Mirties priežasčių registras
NVI – Nacionalinis vėžio institutas
PASP – pirminės asmens sveikatos priežiūros paslaugos
PAASP – pirminės ambulatorinės asmens sveikatos priežiūros paslaugos
PAP – gimdos kaklelio citologinis tyrimas
PGR – polimerazės grandininė reakcija
PSDF – Privalomojo sveikatos draudimo fondas
PSO – Pasaulio sveikatos organizacija
PT – palyginamieji tyrimai
SAM – Sveikatos apsaugos ministerija
SCJ – jungtis tarp plokščiojo ir stulpinio epitelio (squamocolumnar junction)
TZ – transformacijos zona
VAIN – makšties intraepitelinė neoplazija (vaginal intra-epithelial neoplasia)
VASPVT – Valstybinė akreditavimo sveikatos priežiūros veiklai tarnyba
VLK – Valstybinė ligonių kasa
VR – Vėžio registras
VUL SK – Vilniaus universiteto ligoninė Santaros klinikos (Rytų koordinavimo centras)
ŽPV – žmogaus papilomos virusas
ĮVADAS
Dabartinėse 27 Europos Sąjungos (ES) valstybėse narėse kasmet registruojama apie 34 000 naujų gimdos kaklelio vėžio (GKV) atvejų ir 13 000 mirčių dėl šios ligos. Nepaisant didelės pastarųjų dešimtmečių pažangos mažinant GKV naštą, daugelyje vadinamųjų naujųjų valstybių narių, įstojusių į ES po 2003 m., rizika susirgti šia liga tebėra didelė. Didelis sergamumo GKV skirtumas tarp senųjų ir naujųjų ES valstybių narių iš esmės atspindi nuolatinių GKV PP nebuvimą arba netinkamą įgyvendinimą praėjus daugiau nei dešimčiai metų po organizuotų gyventojų skaičiaus patikrinimo programų pagal Europos kokybės užtikrinimo gaires, kurias bendrai rekomendavo ES sveikatos apsaugos ministrai (Europos Sąjungos Taryba, 2003).
Remiantis Pasaulinės sveikatos organizacijos (PSO) ekspertų išvadomis, efektyviai vykdant patikros programas, t. y. ankstyvąją vėžio diagnostiką ir gydymą, sergamumą piktybiniais navikais galima sumažinti 25 proc., o mirtingumą nuo jų – net 50 proc.
Patikros programų efektyvumui užtikrinti būtinos šios prielaidos:
7) pakankamas nuolatinis finansavimas.
Atrankinių GKV PP nauda ir efektyvumas įrodytas įvairiose šalyse. Pvz., atrankinė moterų patikra dėl gimdos kaklelio patologijos Suomijoje pradėta vykdyti daugiau kaip prieš 50 metų. Per šį laikotarpį Suomijos moterų sergamumas gimdos kaklelio vėžiu reikšmingai sumažėjo ir šiuo metu yra 4–5 kartus mažesnis nei Lietuvos moterų. Remiantis įvairių šalių patirtimi, vykdant patikros programas sergamumą gimdos kaklelio vėžiu galima sumažinti 30–70 proc., o mirtingumą – apie 30 proc. per 5 metus. Moksliniais tyrimais nustatyta, kad GKV PP vykdymo intensyvumas (dažnumas ir apimtis) tiesiogiai susijęs su mirtingumo nuo gimdos kaklelio vėžio mažėjimu (Dijkstra MG et., 2016).
Šiuo metu pagrindinis GKV PP metodas yra gimdos kaklelio citologinis tyrimas (PAP testas). Pastaraisiais metais pasaulyje į šias programas įtraukiamas ir žmogaus papilomos viruso (ŽPV) DNR tyrimas kaip alternatyvus pirminis patikros metodas, kurio efektyvumas pagrįstas moksliniais tyrimais (Ronco G et al, 2014, Dijkstra MG et al., 2016).
Kol kas nėra bendros nuomonės, kokio amžiaus moterims optimalu pradėti atlikti ir baigti patikras. Tai priklauso nuo moterų sergamumo GKV įvairiose amžiaus grupėse, finansinių šalies galimybių ir kt. Daugumoje ES valstybių atrankinės patikros dėl GKV atliekamos moterims nuo 20–30 metų iki 60–64 metų amžiaus kas 3–5 metus. Remiantis kai kurių studijų duomenimis, rekomenduojama pradėti tikrinti moteris, sulaukusias 20 metų, bet ne vyresnes kaip 30 metų (Landy R et al, 2014). Kita vertus, patikros baigimo amžius neribojamas, nors manoma, kad vyresnių nei 60 metų moterų patikros efektyvumas mažesnis, ypač jei toms moterims anksčiau atliktų citologinio tyrimų rezultatai buvo neigiami (Wang J et al, 2017).
Šiuo metu įvairios ES šalys yra parengusios ir patvirtinusios GKV PP vykdymo rekomendacijas, kurios yra Europos GKV PP vykdymo rekomendacijų išdava.
I SKYRIUS. EPIDEMIOLOGIJA IR GIMDOS KAKLELIO VĖŽIO PATIKROS PROGRAMOS VALDYMAS
1.1. Gimdos kaklelio vėžio patikros programos valdymo pagrindiniai principai.
1.1.1. Gimdos kaklelio vėžio epidemiologinė situacija Lietuvoje
· Sergamumas Lietuvoje (pokyčiai ir pastarojo laikotarpio duomenys)
· Lietuvos gyventojų mirties nuo gimdos kaklelio piktybinių navikų rodiklis, jų pokyčiai
· Moterų, susirgusių gimdos kaklelio vėžiu, išgyvenamumo rodiklis ir jo pokyčiai
Gimdos kaklelio vėžys pasaulyje užima ketvirtą vietą tarp moterų piktybinių navikų ir yra viena dažniausių moterų mirties nuo vėžio priežasčių. Kasmet pasaulyje nustatoma > 0,5 mln. naujų GKV atvejų ir kiekvienais metais nuo šios ligos miršta apie 250 000 moterų. Daugiau kaip 4 iš 5 naujų ligos atvejų diagnozuojami besivystančiose šalyse. 2018 m. duomenimis, Europoje didžiausias standartizuotas pagal pasaulio populiaciją sergamumo rodiklis nustatytas Latvijoje (25,0/100 000 moterų), mažiausias – Maltoje (3,5/100 000 moterų), skirtumas – daugiau kaip 7 kartai. Vidutinis pasaulio sergamumo GKV rodiklis 2018 m. siekė 13,1/100 000 moterų (GLOBOCAN, 2018).

1.1.1.1 pav. Sergamumo GKV rodikliai (100 000 moterų) Europos šalyse 2018 m. (GLOBOCAN, 2018)
2018 m. duomenimis, Europoje didžiausias standartizuotas pagal pasaulio populiaciją mirtingumo rodiklis nustatytas Rumunijoje (8,9/100 000 moterų), mažiausias – Suomijoje (0,9/100 000 moterų), skirtumas – 10 kartų. Vidutinis pasaulio mirtingumo nuo GKV rodiklis 2018 m. buvo 6,9/100 000 moterų (GLOBOCAN, 2018).
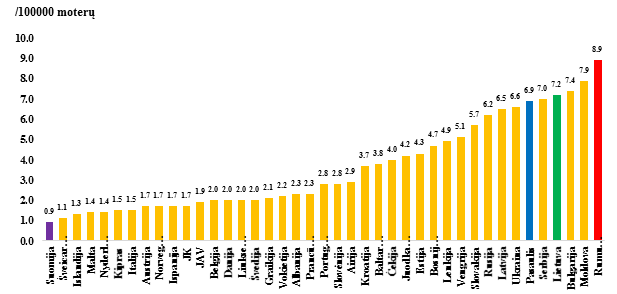
1.1.1.2 pav. Mirtingumo nuo GKV rodikliai (100 000 moterų) Europos šalyse 2018 m. (GLOBOCAN, 2018)
2018 m. duomenys rodo, kad Lietuvoje sergamumas GKV buvo ketvirtoje vietoje, o tarp 15–44 metų amžiaus moterų – antroje vietoje. 2018 m. užregistruota 431 moteris, serganti GKV, iš jų tik kas trečiai nustatyta I ligos stadija. 2008–2012 m. duomenimis, Lietuvoje standartizuotas sergamumas GKV buvo 20,4/100 000 moterų, o 2018 m. – 18,9/100 000 moterų (GLOBOCAN, 2018). Taigi mūsų šalyje sergamumas GKV per 2008–2018 metus reikšmingai nekito. 2018 m. duomenimis, tarp 431 susirgusios GKV moters daugiau nei pusė visų moterų (55,9 proc.) buvo 40–64 metų amžiaus (n = 241), 75 (17,4 proc.) – 15–39 metų amžiaus, 115 (26,7 proc.) – 65 metų ir vyresnės.
2018 m. duomenimis, Lietuvoje mirtingumas nuo GKV buvo dešimtoje vietoje, o tarp 15–44 metų amžiaus moterų – pirmoje vietoje. 2008 m. duomenimis, Lietuvoje standartizuoto mirtingumo nuo GKV rodiklis buvo 7,9/100 000 moterų, 2018 m. – 7,2/100 000 moterų (GLOBOCAN, 2018). 2008–2018 metais mirtingumas nuo GKV Lietuvoje mažėjo po 1,4 proc. per metus. 2018 m. duomenimis, tarp 209 mirusių nuo GKV moterų beveik pusė visų moterų (47,4 proc.) buvo 40–64 metų amžiaus (n = 99), tik 15 (7,1 proc.) – 15–39 metų amžiaus, 95 (45,5 proc.) – 65 metų ir vyresnio amžiaus.
Dauguma GKV atvejų susirgimas siejamas su lėtine žmogaus papilomos viruso (ŽPV) infekcija, apie 70 proc. visų GKV atvejų sukelia 16 ir 18 ŽPV tipai. 1983 m. iš gimdos kaklelio vėžio biopsijos mėginių buvo išskirtas ŽPV ir ištirti priežastiniai ryšiai tarp ŽPV ir gimdos kaklelio vėžio. Didžiausias ŽPV paplitimas nustatytas tarp jaunų (15–30 metų) moterų, tačiau užsikrėtimo rizika išlieka visą gyvenimą. Dauguma moterų, užsikrėtusių ŽPV, vėžiu nesuserga. Gimdos kaklelio displazijų vystymosi amžiaus vidurkis – 25–45 metai (naujos infekcijos dažnis mažėja, tačiau didėja persistencijos rizika). GKV išsivystymo amžiaus vidurkis – 45–65 metai.
Vertinant išgyvenamumo rodiklius susirgus GKV, nustatyta, kad 5 metus išgyvena apie 90 proc. moterų, kurioms nustatytas pirmos stadijos GKV, 60–65 proc. – kurioms nustatytas antros stadijos GKV, 40–45 proc. – kurioms nustatytas trečios stadijos GKV ir tik 18–28 proc. – kurioms nustatytas ketvirtos stadijos GKV.
1.1.2. Gimdos kaklelio vėžio patikros programos reglamentavimo teisinė bazė
Lietuvos gimdos kaklelio vėžio patikros programa parengta ir vykdoma įgyvendinant Nacionalinę vėžio profilaktikos ir kontrolės 2014–2025 metų programą ir Nacionalinės vėžio profilaktikos ir kontrolės 2014–2025 metų programos įgyvendinimo 2017–2019 metais priemonių planą, vadovaujantis juose numatytomis ankstyvosios piktybinių navikų diagnostikos veiklos kryptimis, užtikrinant organizuotos gimdos kaklelio vėžio patikros programos vykdymą ir įdiegiant atrankinės patikros dėl gimdos kaklelio vėžio kokybės užtikrinimo bei kokybės kontrolės reikalavimus, pagrįstus Europos mokslininkų parengtomis gimdos kaklelio vėžio patikros kokybės užtikrinimo gairėmis.
GKV PP vykdoma kartu su gimdos kaklelio piktybinių navikų prevencinių priemonių, apmokamų iš PSDF biudžeto lėšų, finansavimo programa, patvirtinta Lietuvos Respublikos sveikatos apsaugos ministro 2004 m. birželio 30 d. įsakymu Nr. V-482 „Dėl Gimdos kaklelio piktybinių navikų prevencinių priemonių, apmokamų iš PSDF biudžeto lėšų, finansavimo programos patvirtinimo“, ir derinama su Klinikinių laboratorinių tyrimų kokybės gerinimo programa, patvirtinta Lietuvos Respublikos sveikatos apsaugos ministro 2012 m. sausio 12 d. įsakymu Nr. V-17 „Dėl Klinikinių laboratorinių tyrimų kokybės gerinimo programos patvirtinimo“, Sveiko senėjimo užtikrinimo Lietuvoje 2014–2023 m. planu ir kitomis onkologinių ligų rizikos veiksnių bei sveikatą lemiančių veiksnių valdymo specialiosiomis programomis, tarpinstituciniais veiklos planais ir kitais planavimo dokumentais.*
Įgyvendinant patikros programą asmens sveikatos priežiūros paslaugos teikiamos vadovaujantis Lietuvos Respublikos Konstitucija, Lietuvos Respublikos sveikatos sistemos įstatymu, Lietuvos Respublikos sveikatos draudimo įstatymu, Lietuvos Respublikos sveikatos priežiūros įstaigų įstatymu, Lietuvos Respublikos medicinos praktikos įstatymu, Lietuvos Respublikos pacientų teisių ir žalos sveikatai atlyginimo įstatymu ir kitais teisės aktais.
Duomenų valdytojai, skirtinguose GKV PP vykdymo etapuose užtikrinantys duomenų teikimą/tvarkymą, duomenis valdo ir tvarko laikantis GKV PP ir kituose teisės aktuose numatytų procedūrų, bei duomenų tvarkymo tikslų. Duomenims valdyti ir tvarkyti užtikrinamos tinkamos techninės ir organizacinės priemonės, atitinkančios Lietuvos Respublikoje nustatytus asmens duomenų apsaugos reikalavimus.
Uždaviniai GKV PP tikslui įgyvendinti (pagal įgyvendinamus teisės aktus):
· galutinis GKV PP tikslas yra sumažinti sergamumą ir mirtingumą nuo gimdos kaklelio vėžio, patiriant kuo mažesnę naštą, mažiausią neigiamą poveikį moterims (žmogiškieji kaštai) ir mažiausias ekonomines išlaidas;
· užtikrinti, kad dalyvauti patikros programoje būtų pakviestos visos tikslinei populiacijai priklausančios moterys, kad neatvykusios būtų kviečiamos pakartotinai ir kad dalyvaujančių GKV PP moterų aprėptis būtų tokia, kokia yra rekomenduojama Europos mokslininkų;
· analizuoti patikros programos procesų įgyvendinimą, jų atlikimo laiko tinkamumą;
· vykdant patikros programą paslaugas teikti pritaikant Europos mokslininkų parengtas gimdos kaklelio vėžio patikros kokybės užtikrinimo gaires ir mokant tokias paslaugas teikiančius specialistus, kad būtų išvengta klaidų ir būtų užtikrinamas tikslinės populiacijos moterų saugumas;
· sistemiškai vykdyti kokybės stebėseną ir vertinti patikros programos procedūrų ir procesų kokybės rodiklius;
· viešinti patikros programos rezultatus;
* Pažymime, kad Gimdos kaklelio vėžio patikros programos kokybės reikalavimų projektas (GKV PP projektas) buvo peržiūrėtas ir iš dalies pakoreguotas, atsižvelgiant į įsigaliojusiuose teisės aktuose įtvirtintas nuostatas, susijusias su gimdos kaklelio vėžio ankstyvosios diagnostikos programos vykdymu.
Norime atkreipti dėmesį, kad GKV PP projektas yra parengtas įtraukiant ateityje planuojamus ankstyvosios diagnostikos programos organizavimo ir vykdymo pakeitimus. Kadangi planuojama, jog informavimo dėl gimdos kaklelio piktybinių navikų ankstyvosios diagnostikos paslaugą teiks ne pirminės sveikatos priežiūros centrai, o patikros dėl onkologinių ligų programų koordinavimo centras, atitinkamai, GKV PP projekte jau numatytos minėto koordinavimo centro funkcijos bei atsakomybės. Todėl galiojančių poįstatyminių teisės aktų ir GKV PP projekto suderinimas bus išspręstas ateityje, nuosekliai keičiant ir patvirtinant naujus Gimdos kaklelio vėžio patikros programą reglamentuojančius teisės aktus.
· rinkti, kaupti ir analizuoti visus duomenis, reikalingus GKV PP, tolesnei tikslinės populiacijos moterų sveikatos būklės stebėsenai vykdyti (nuo patikros programos tikslinės grupės sąrašo sudarymo iki visų programos etapų ir tolesnio pacientės gydymo ir išgyvenamumo stebėsenos), GKV PP efektyvumui įvertinti ir sprendimams priimti;
· užtikrinti visapusišką ir kokybišką duomenų (rezultatų) registraciją ir viešą informacijos prieinamumą.
1.1.4. Gimdos kaklelio vėžio patikros programos organizacinė struktūra
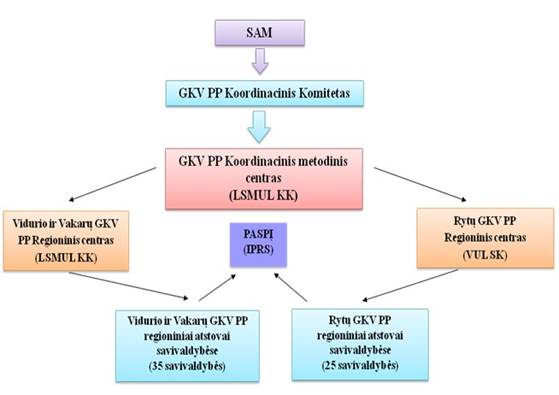
Lietuvoje GKV PP įgyvendina Sveikatos apsaugos ministerija (SAM), Nacionalinė vėžio profilaktikos ir kontrolės programos įgyvendinimo ir onkologinės pagalbos organizavimo stebėsenos taryba (NVPKPĮOPOST) prie SAM, GKV PP koordinavimo komitetas (GKV PP KK), GKV PP metodinis centras (GKV PP MC, LSMUL KK), GKV PP regioniniai koordinavimo centrai (GKV PP RKC), GKV PP koordinatoriai savivaldybėse ir universitetai. Išsamesnė informacija apie šias institucijas ir jų vykdomą veiklą pateikiama 1.1.4.1 pav. ir 1.1.4.1 lentelėje.
 1.1.4.1 pav. GKV PP organizavimo procesas
1.1.4.1 pav. GKV PP organizavimo procesas
1.1.4.1 lentelė. Pagrindinės už GKV PP organizavimą ir vykdymą atsakingos institucijos ir jų veikla
| Institucijos |
Veiklos |
| Nacionalinė vėžio profilaktikos ir kontrolės programos įgyvendinimo ir onkologinės pagalbos organizavimo stebėsenos taryba (NVPKPĮOPOST) prie SAM (posėdžiai 1–2 kartus per metus) |
- Vertina onkologinės pagalbos organizavimą Lietuvoje. - Atlieka programų vertinimą pagal savo patvirtintus vertinimo kriterijus. - Stebi priemonių plane numatytų priemonių įgyvendinimo eigą ir rezultatus. - Teikia siūlymus dėl priemonių įtraukimo į programos įgyvendinimo priemonių planą ir dėl onkologinės pagalbos organizavimo tobulinimo. - Teikia siūlymus ir sprendimus, susijusius su onkologinių ligų patikros programų vykdymo tobulinimu. |
| Sveikatos apsaugos ministerija |
- Nustato teisinius ir politinius pagrindus, susijusius su GKV PP įgyvendinimu (rengia ir tvirtina teisės aktus). - Sprendžia dėl naujų technologijų, inovacijų, naujų metodų taikymo programoje. - Tvirtina onkologinės pagalbos organizavimo Lietuvoje vertinimo kriterijus. - Dalyvauja nacionaliniuose komitetuose, darbo grupėse, skirtose onkologinių ligų patikros programoms, ir priima atitinkamus sprendimus.
Atskaitinga LR Seimui |
| GKV PP koordinavimo komitetas |
- Koordinuoja ir kontroliuoja GKV PP nacionaliniu lygmeniu. - Inicijuoja GKV PP strateginius pokyčius. - Teikia atsakingoms institucijoms informaciją apie inovacijas ir naujus metodus, kurie gali būti taikomi įgyvendinant GKV PP. - Inicijuoja reikiamus teisės aktų pakeitimus. - Vertina GKV PP ir teikia rekomendacijas. - Sprendžia dėl programos mokslinės analizės.
Atskaitingas NVPKPĮOPOST |
| GKV PP metodinis centras (LSMUL KK) |
- Inicijuoja ir teikia GKV PP KK svarstyti GKV PP vykdymo metodikos pokyčius. - Dalyvauja atliekant GKV PP valdyti reikalingos informacinės sistemos kūrimo, diegimo, administravimo darbus. - Rengia ir įgyvendina komunikacijos strategiją. - Atlieka GKV PP kokybės rodiklių ir epidemiologinį vertinimą. - Inicijuoja taktinius GKV PP pokyčius. - Organizuoja GKV PP vykdančių specialistų mokymus. - Organizuoja ir vykdo priemonių ir įrangos, reikalingų GKV PP vykdymui užtikrinti, viešuosius pirkimus vykdant GKV PP, kaip, pvz., ŽPV sistemų pirkimai, terpių pirkimai ir pan.). - Inicijuoja ir vykdo auditą.
Atskaitingas GKV PP KK |
| GKV PP regioniniai centrai (LSMUL KK ir VUL SK) |
- Vykdo ir administruoja GKV PP pagal kokybės užtikrinimo reikalavimus. - Vykdo kokybės kontrolės funkciją kiekviename GKV PP proceso etape (pagal GKV PP kokybės užtikrinimo reikalavimus). - Užtikrina bendradarbiavimą tarp institucijų, susijusių su programos vykdymu (ASPĮ, laboratorijų, centrų ir kt.).
Atskaitingi GKV PP MC (LSMUL KK) |
| GKV PP koordinatoriai savivaldybėms / centruose |
- Užtikrina programos vykdymą savivaldybėse. - Bendradarbiauja su ASPĮ. - Renka duomenis ir teikia informaciją atitinkamam GKV PP RC.
Atskaitingi GKV PP RC |
| Universitetas (LSMU) |
- Vykdo GKV PP kokybės rodiklių stebėseną, vertinimą ir rengia ataskaitas. - Vertina GKV PP epidemiologinį efektyvumą. - Konsultuoja dėl efektyvesnio GKV PP įgyvendinimo. - Konsultuoja rengiant teisės aktus, susijusius su GKV PP. - Teikia mokslu grįstą informaciją. - Rengia publikacijas pagal GKV PP ataskaitas.
Atskaitingas GKV PP MC |
1.1.4.1. Gimdos kaklelio vėžio patikros programos regioninių koordinavimo centrų atsakomybė, veikla ir funkcijos
Už GKV PP vykdymą atsakingi du atrankinės patikros dėl onkologinių ligų programų regioniniai koordinavimo centrai.
Lietuvos sveikatos mokslų universiteto ligoninė Kauno klinikos yra Vidurio ir Vakarų regiono atrankinės patikros dėl onkologinių ligų programų koordinavimo centras, atsakingas už programos vykdymą Akmenės r., Birštono, Jonavos r., Joniškio r., Jurbarko r., Kaišiadorių r., Kalvarijos, Kauno m., Kauno r., Kazlų Rūdos, Kelmės r., Kretingos r., Kėdainių r., Klaipėdos m., Klaipėdos r., Marijampolės, Mažeikių r., Neringos, Pagėgių, Pakruojo r., Palangos m., Plungės r., Prienų r., Radviliškio r., Raseinių r., Rietavo, Skuodo r., Šakių r., Šiaulių m., Šiaulių r., Šilalės r., Šilutės r., Tauragės r., Telšių r., Vilkaviškio r. savivaldybėse.
Vilniaus universiteto ligoninė Santaros klinikos yra Rytų regiono atrankinės patikros dėl onkologinių ligų programų koordinavimo centras, atsakingas už programos vykdymą Alytaus m., Alytaus r., Anykščių r., Biržų r., Druskininkų, Elektrėnų r., Ignalinos r., Kupiškio r., Lazdijų r., Molėtų r., Panevėžio m., Panevėžio r., Pasvalio r., Rokiškio r., Šalčininkų r., Širvintų r., Švenčionių r., Trakų r., Ukmergės r., Utenos r., Varėnos r., Vilniaus m., Vilniaus r., Visagino r., Zarasų r. savivaldybėse. Koordinavimo centrus skiria Lietuvos Respublikos SAM.
Regioniniai koordinavimo centrai yra atsakingi už GKV PP koordinavimą, vykdymą (1.1.4.1.1 ir 1.1.4.1.2 pav.) ir vykdymo kokybės užtikrinimą regione (1.1.4.1.1 lentelė).
1.1.4.1.1 lentelė. Pagrindinė GKV PP regioninių koordinavimo centrų atsakomybė ir veikla
| Atsakomybė |
Veikla |
| Tikslinės grupės atranka |
- Regioninių centrų ESPB IS/GKV PP informacinėse posistemėje esančios informacijos atnaujinimas - Moterų, kurios kviečiamos dalyvauti programoje, atranka - Kvietimų dalyvauti programoje tvarkaraščio sudarymas |
| Kvietimo proceso užtikrinimas |
- Kvietimo dalyvauti programoje ir informacinio pranešimo siuntimas - Tyrimo registracijos tikslinimas - Priminimo apie kvietimą siuntimas (po 3 mėnesių) - Pakartotinis kvietimas (po 3 arba 5 metų). |
| Informavimas apie tyrimų rezultatus |
- Tyrimo rezultatų (atsakymų) perdavimas moterims - Rekomendacijų dėl tolesnių veiksmų, atsižvelgiant į tyrimo rezultatus, teikimas |
1.1.4.1.1 pav. GKV PP organizavimo procesas
1.1.4.1.2 pav. Gimdos kaklelio vėžio atrankinės patikros programos vykdymo schema
GKV PP regioniniai koordinavimo centrai steigiami universitetinių ligoninių padaliniuose Vidurio ir Vakarų Lietuvoje – LSMUL KK, Rytų Lietuvoje – VUL Santaros klinikose), atsakinguose už efektyvią profilaktinių programų veiklą.
GKV PP regioninių koordinavimo centrų koordinavimo funkcijos:
· GKV PP tikslinei populiacijai priklausančių moterų kvietimo dalyvauti programoje organizavimas (tikslinei populiacijai priklausančių moterų sąrašo sudarymas, kviečiamų einamaisiais metais moterų atranka, asmeninio kvietimo atvykti į PASP paslaugas teikiančią ASPĮ organizavimas, apsilankymo laiko ir kitų sąlygų koordinavimas ir kt.);
· pakviestų moterų atvykimo dalyvauti GKV PP stebėsena ir prireikus kartotinio kvietimo organizavimas;
· moterų, kurioms vykdant GKV PP nustatyta sveikatos būklės pokyčių, siuntimo gauti tolesnių asmens sveikatos priežiūros paslaugų stebėsena (ar taikytos diagnostikos, gydymo procedūros, per kiek laiko nuo ligos įtarimo patvirtinta diagnozė, per kiek laiko nuo diagnozės patvirtinimo pradėtos taikyti gydymo procedūros ir kt.), prireikus – siuntimo gauti tolesnių asmens sveikatos priežiūros paslaugų organizavimas;
· bendradarbiavimas su GKV PP paslaugas teikiančiomis ASPĮ, GKV PP KK, kitomis institucijomis, siekiant optimizuoti GKV PP koordinavimo procesą, identifikuoti ir išspręsti problemas;
· duomenų apie dalyvaujančias GKV PP moteris valdymas ir teikimas ESPBI IS/GKV PP posistemei;
· kitų funkcijų, susijusių su GKV PP koordinavimu, vykdymas.
GKV PP regioninių koordinavimo centrų metodinės GKV PP funkcijos:
· GKV PP vykdymo metodikos kontrolė;
· GKV PP vykdymo metodikos pokyčių inicijavimas ir jų teikimas GKV PP KK;
· GKV PP koordinuoti reikalingos informacinės sistemos pritaikymas, administravimas, valdymas;
· GKV PP paslaugas teikiančių ASPĮ ir GKV PP regioninių koordinavimo centrų konsultavimas;
· GKV PP koordinavimo procesui reikalingų (tvarkomų) duomenų nustatymas, siūlymų dėl duomenų rinkimo, registravimo, formų ir kt. optimizavimo teikimas;
· GKV PP regioninių koordinavimo centrų veiklos apibendrinimas, vertinimas, siūlymų dėl veiklos tobulinimo rengimas;
· GKV PP įgyvendinimo rodiklių (proceso, rezultato, kokybės ir kt.) stebėsena, vertinimas, siūlymų dėl GKV PP koordinavimo tobulinimo rengimas;
· ataskaitų apie GKV PP įgyvendinimo rezultatus rengimas, viešinimas, pristatymas;
· GKV PP poveikio Lietuvos gyventojų sergamumui, mirtingumui vertinimas;
· efektyvių komunikacijos asmens sveikatos priežiūros specialistams ir visuomenei strategijų kūrimas, vystymas ir diegimas;
· GKV PP vykdančių specialistų mokymų organizavimas;
· priemonių ir įrangos, reikalingų GKV PP vykdymui užtikrinti, viešųjų pirkimų organizavimas (reikia teisininkų / SAM komentaro);
· invazinio GKV audito koordinavimas ir vykdymas;
· kitų funkcijų, susijusių su metodiniu vadovavimu, vykdymas.
1.1.4.2. GKV PP koordinavimo komiteto funkcijos
GKV PP koordinavimo komitetas vykdo šias funkcijas:
· nacionalinis GKV PP valdymas, koordinavimas ir kontrolė;
· GKV PP paslaugas teikiančių ASPĮ ir GKV PP RKC konsultavimas;
· GKV PP įgyvendinimo rodiklių (proceso, rezultato, kokybės ir kt.) stebėsena ir vertinimas;
· reguliarus ataskaitų apie GKV PP rezultatus vertinimas, išvadų ir rekomendacijų teikimas;
· GKV PP RKC veiklos apibendrinimas, vertinimas, siūlymų dėl veiklos tobulinimo rengimas, pokyčių inicijavimas;
· GKV PP koordinavimo procesui reikalingų (tvarkomų) duomenų nustatymas, siūlymų dėl duomenų rinkimo ir kt. teikimas;
· problemų analizavimas ir pasiūlymų LR SAM dėl GKV PP koordinavimo tobulinimo rengimas;
· rekomendacijų LR SAM ir GKV PP RKC dėl naujų metodų taikymo vykdant GKV PP teikimas;
· prireikus teisės aktų ir metodinių rekomendacijų, susijusių su GKV PP vykdymu, pakeitimų inicijavimas;
· kitų funkcijų, susijusių su metodiniu vadovavimu, vykdymas.
Rekomenduojama į GKV PP koordinavimo komiteto sudėtį įtraukti 7–9 specialistus, atstovaujančius SAM, GKV PP regioniniams koordinavimo centrams (LSMUL KK ir VUL SK) (2 specialistai iš GKV PP metodines funkcijas vykdančio koordinavimo centro ir 1 specialistas iš kito koordinavimo centro (pagal programos poreikį: gydytojas akušeris-ginekologas, visuomenės sveikatos specialistas, epidemiologas, gydytojas onkologas, laboratorinės medicinos specialistas, gydytojas patologas), LSMU, VU, VLK, pacientų organizacijų atstovus. Pagal poreikį ekspertizei ar konsultacijoms gali būti kviečiami kiti, papildomi specialistai.
GKV PP koordinavimo komiteto posėdžiai rengiami 4 kartus per metus (kas ketvirtį). GKV PP kokybės užtikrinimo reikalavimų ataskaitų analizė ir vertinimas atskirose savivaldybėse ar regionuose svarstomi 4 kartus per metus kas ketvirtį rengiamuose posėdžiuose. GKV PP kokybės rodiklių peržiūra ir vertinimas svarstomi 1 kartą per metus.
II Skyrius. GIMDOS KAKLELIO VĖŽIO PATIKROS PROGRAMOS KOKYBĖS UŽTIKRINIMAS
2.1. Gimdos kaklelio vėžio patikros programos kokybės užtikrinimo pagrindiniai principai
Lemiamą vaidmenį užtikrinant bendrą GKV PP sėkmę vaidina pirminė sveikatos priežiūros grandis, nes jos aplinkoje atliekama didžioji dalis GKV PP tyrimų. Teikiant kokybiškas GKV PP paslaugas moterims itin svarbus ir visuomenės sveikatos specialistų, ir asmens sveikatos priežiūros specialistų vaidmuo.
Pirminės sveikatos priežiūros specialistai ne tik atlieka citologinių ar ŽPV tyrimų ėmimo procedūrą, bet ir užtikrina, kad moterų sveikata būtų stebima toliau. Gydytojai atlieka svarbų vaidmenį skatinant naudotis GKV PP ir perduodant svarbiausią informaciją, susijusią su GKV PP.
Bendras GKV PP proceso tikslas yra užtikrinti, kad moterys gautų reikiamą, adekvačią asmens sveikatos priežiūrą tinkamai ir laiku, atsižvelgiant į saugumą, patogumą ir orumą visame GKV PP procese.
GKV PP procesas pirminės sveikatos priežiūros grandyje aprašytas GKV PP kokybės reikalavimuose ir standartuose. Juose svarbiausi patikros vykdymo aspektai nagrinėjami kokybės požiūriu.
Pirminės sveikatos priežiūros įstaigos ar klinikos turi sugebėti įrodyti, kad atitinka kokybės reikalavimus ir standartus, vykdydamos GKV PP proceso kokybės savikontrolę. GKV PP gali padėti įvertinti atitiktį keliems nurodytiems standartams ir su jais susijusiems tikslams, teikdama statistinius duomenis, gaunamus iš GKV PP proceso.
2.2. Gimdos kaklelio vėžio patikros programos kokybės kontrolės sistema (reikalavimai ir standartai)
GKV PP valdymas pavaizduotas 1.1.4.1 paveiksle ir 1.1.4.1 lentelėje.
Galima išskirti šiuos GKV PP kokybės kontrolės valdymo etapus:
2) kokybiška moterų atranka į GKV PP, kvietimų rengimo ir registravimo kokybinių reikalavimų užtikrinimas;
5) laboratorinės įrangos ir medžiagų, reikalingų GKV PP, kokybės kontrolės reikalavimų užtikrinimas;
Organizaciniai reikalavimai
| Kokybės reikalavimas |
Terminas |
| Licencijavimas ir akreditacija |
Pakartotinis laboratorijos licencijavimas atliekamas praėjus 3 metams po pirmosios licencijos VASPVT gavimo, po to licencijavimas vykdomas kas 5 metus. Laboratorijos akreditacija yra savanoriška |
| Licencija gaunama atliekant laboratorijos išorės auditą. Licencija turi būti patvirtinta licencijos įstaigos išduotais dokumentais. Ji turi apimti tiek citologinius, tiek ŽPV tyrimus. Laboratorija turi turėti LIS, kurioje įdiegta patikima duomenų apsauga su pacientų duomenų atsekamumu ir ji turi būti susieta su ESPBI IS/GKV PP posisteme. |
Pastaba: laboratorijų licencijavimas ir akreditacija (kurią nustato LST EN ISO 15189) apima patalpas, personalo kvalifikaciją, mokymą ir kompetencijas, įrangą, laboratorijų informacines sistemas ir kokybės vadybos sistemas.
| Kokybės reikalavimas |
Terminas |
| Duomenų apsauga |
|
| Moterų (pacienčių) asmens duomenų valdymas ir tvarkymas turi atitikti ES bendrąjį duomenų apsaugos reglamentą ir nacionalinius teisės aktus. |
| Kokybės reikalavimas |
Terminas |
| Darbuotojų sveikatos ir saugos reikalavimų laikymasis |
|
| Laboratorijos kokybiniai reikalavimai ir standartai turi atitikti LR teisės aktus, nustatančius patologijos tyrimų ir laboratorinės medicinos kokybės reikalavimus. Laboratorija turi atitikti teisės aktuose nustatytus darbuotojų sveikatos ir saugos reikalavimus. Laboratorijos darbo aplinka turi atitikti Lietuvos Respublikos higienos normas. |
| Kokybės reikalavimas |
Terminas |
| Kokybės vadybos sistema |
|
| Laboratorijoje turi būti įdiegta kokybės vadybos sistema, kaip reikalaujama pagal licencijai gauti taikomus teisės aktus ir akreditacijos standartą. Turi būti paskirtas už kokybės vadybą atsakingas asmuo, palaikantis ryšį su GKV PP KC, kad išspręstų visas su kokybės vadyba susijusias problemas. Apie visus su GKV PP susijusius skundus pranešama GKV PP MC. |
| Kokybės reikalavimas |
Terminas |
| Elektroninių duomenų mainų su programa saugumas |
|
| Siekiant saugiai keistis elektroniniais duomenimis, tarp laboratorijos ir GKV PP KC turi būti įdiegtas virtualus privatus tinklas. |
| Kokybės reikalavimas |
Terminas |
| Laboratorijos informacijos valdymo sistema |
|
| Laboratorijoje turi būti įdiegta ir veikti kompiuterinė laboratorijos informacijos valdymo sistema, kuri įrengta saugioje patalpoje atitinkančioje laboratorijos saugumo standartus. Prieiga prie laboratorijos informacinės sistemos, teikiama naudojantis privilegijų lygio kontrole. Sistema turi galėti generuoti periodinę kokybės metriką ir audito ataskaitas GKV PP KC. |
| Kokybės reikalavimas |
Terminas |
| Duomenų kaupimas |
|
| Duomenų kaupimo sistema įrašo duomenis, kurių reikalauja GKV PP KC (ESPBI IS/GKV PP posistemėje), kuri gaunama iš gimdos kaklelio citologinio ir ŽPV tyrimų formos įrašų. |
| Kokybės reikalavimas |
Terminas |
| Elektroninių duomenų mainų su programa formatas ir laikas |
|
| Laboratorijų informacinė sistema (LIS) gauna ir perduoda reikiamus duomenis į programą reikiamu formatu, kaip numatyta ESPBI IS/GKV PP posistemės specifikacijose (pranešimų ir rezultatų failai). Laboratorija taip pat gauna informaciją iš programos nurodytais formatais ir perduoda ją savo informacinėms sistemoms. Laboratorija turi galimybę palaikyti elektroninį ryšį tarp personalo narių ir ESPBI IS/GKV PP posistemės programos naudodama saugiuosius protokolus (pvz., saugųjį el. paštą, VPN protokolus). |
| Kokybės reikalavimas |
Terminas |
| Ataskaitų teikimas |
|
| Programa (ESPBI IS/GKV PP posistemė ir LIS) įrašo tyrimų rezultatus, įskaitant kombinuotus citologinius ir ŽPV duomenis. Programa taip pat užregistruoja asmens, teikiančio citologinio ir ŽPV tyrimų ataskaitą, tapatybę. |
| Kokybės reikalavimas |
Terminas |
| Elektroninių užsakymų ir rezultatų galimybės ir formatas |
|
| Pageidautina, kad laboratorijos pagal nurodytą pranešimų siuntimo standartą galėtų elektroniniu būdu priimti užsakymus ir elektroniniu būdu pateikti rezultatus gydytojams ar klinikoms ir gauti duomenis iš jų. Elektroninis laboratorijos užsakymo formatas pagrįstas ESPBI IS/GKV PP posistemės pranešimų standarto laboratorinių užsakymų pranešimų specifikacijomis. Pagrįstiems ESPBI IS/GKV PP posistemės užsakymams ir rezultatams naudojama pranešimų tarpininko sistema. Fizinę elektroninių užsakymų formą sudaro brūkšninis kodas, kurį panaudojus laboratorijos gautą informaciją automatiškai importuoja į savo duomenų įvedimo sistemą. Be to, LIS atlieka šias funkcijas: · susieja kelių to paties paciento tyrimų rezultatus; · suteikia lengvą prieigą prie ankstesnės paciento gimdos kaklelio citologinės ir histologinės informacijos; · suteikia informaciją apie gautų rezultatų nustatymo ir registravimo mechanizmus atlikus citologinius tyrimus, įskaitant kolposkopijos duomenis, biopsijas ir priežastis, kodėl nebuvo atliktos biopsijos; · pateikia duomenis reikalingus GKV PP įvertinti. |
| Kokybės reikalavimas |
Terminas |
| Eksploatavimo pajėgumų, galimybių ar atitikties kokybės užtikrinimo standartams |
|
| Visi pakeitimai, kurie gali lemti laboratorinių paslaugų kokybės aspektus, įskaitant laboratorijos licencijavimo ir akreditacijos būklę, procesus, sistemos procedūras, analizę ir ataskaitų teikimą, derinami su GKV PP MC. Apie bet kokius pakeitimus iš anksto raštu pranešama GKV PP MC. |
| Kokybės reikalavimas |
Terminas |
| Sveikatos priežiūros įstaigos ir valdžios institucijos |
|
| GKV PP dirbančios laboratorijos privalo tenkinti visus LR SAM ir kitų sveikatos apsaugos institucijų prašymus pateikti duomenis ar ataskaitas. |
Duomenų įvedimas ir pranešimas GKV PP Koordinavimo centrui
| Standartas |
Terminas |
| Prieiga prie gautų citologinio ar ŽPV tyrimo užsakymo formų |
100 proc. per 7 darbo dienas nuo priėmimo dienos |
| Visų pateiktų citologinio ar ŽPV tyrimo užsakymo formų (tik ŽPV tyrimo arba kombinuotiems citologinio tyrimo ir ŽPV tyrimo užsakymų) kopijos elektronine forma ir su numatytos laboratorijos prieigos numeriu nedelsiant pateikiamos GKV PP KC. |
| Standartas |
Terminas |
| Pranešimas apie mėginio gavimą programoje |
95 proc. per 48 val. nuo mėginio gavimo (mažiausiai 80 proc. iki kitos darbo dienos 17.00 val.) |
| Priėmus mėginius, apie tai nedelsiant pranešama GKV PP KC. Kiekviena ASPĮ turi turėti nuolatinį prisijungimo prie ESPBI IS/GKV PP posistemės kodą, kad galėtų stebėti savo siųstų ėminių tyrimo rezultatus. Pranešimas apie laboratorijoje gautą ir užregistruotą GKV PP mėginį perduodamas į ESPBI IS/GKV PP posistemę. |
Pastaba: turi būti įdiegta sekimo sistema arba žurnalas, skirti patikrinti, ar bet kurią dieną GKV PP KC siunčiamų elektroninių pranešimų skaičius yra lygus mėginių, tą dieną įvestų į LIS ar ESPBI IS/GKV PP posistemę, skaičiui. Kiekvieną savaitę tarp GKV PP KC ir laboratorijos sutikrinami išsiųsti ir gauti failai. Tai turi užtikrinti ESPBI IS/GKV PP posistemė.
| Kokybės reikalavimas |
Terminas |
| Duomenų saugojimo grandinės valdymas |
|
| Duomenų tvarkymo procedūros užtikrina patikimą saugojimo grandinę visose analizės fazėse, įskaitant mėginio priėmimą, jo vertinimą, dokumentavimą ir saugojimą. Laboratorijoje sukuriama mėginių apdorojimo audito seka. |
Personalo profesionalumas ir kompetencija
| Kokybės reikalavimas |
Terminas |
| Tęstinis mokymas |
|
| Naudojami personalo mokymo protokolai ir praktikos metodai, apimantys tiek vidinio, tiek išorinio tęstinio mokymo sistemą, o informacija apie mokslo ir medicinos personalo mokymus pranešama GKV PP KC. |
Rezultatų valdymas
| Kokybės reikalavimas |
Terminas |
| Citologinio ir ŽPV tyrimų rezultatų pateikimas |
|
| Pateikiami citologinio ir ŽPV tyrimų rezultatų kodai su GKV PP KC nurodytais duomenimis ir nustatytu formatu. Paprastai reikiamą informaciją sudaro citologinio ir ŽPV tyrimų metodai, citologinio ir ŽPV tyrimų rezultatas, informacija apie potipius ir pateikiamas kontrolinis diapazonas. |
| Kokybės reikalavimas |
Terminas |
| Valdymo rekomendacijų paskyrimas |
|
| Visuose citologinio tyrimo rezultatuose atsižvelgiama į citologinio ir ŽPV tyrimų rezultatus ir pateikiamos valdymo rekomendacijos, pridedamos prie citologinio modelio pagal GKV PP kokybės rodiklių užtikrinimo rekomendacijas. |
Pastaba: jei atliekamas kombinuotas citologinis ir ŽPV tyrimas, tolimesnės proceso valdymo rekomendacijos pateikiamos pagal citologinio ir ŽPV tyrimų rekomendacijų lentelę, skirtą moterims po gydymo, arba panašų GKV PP procesą kitais ŽPV tyrimų atvejais.
| Kokybės reikalavimas |
Terminas |
| Valdymo rekomendacijos, atsižvelgiant į patikros istoriją |
|
| Moters patikros istorija, kurią pateikia tepinėlį imantis asmuo gimdos kaklelio citologinio tyrimo formoje arba gimdos kaklelio citologinio ir ŽPV tyrimų formoje bei ESPBI IS/GKV PP posistemėje (jei tokia istorija yra), nurodoma ir į ją atsižvelgiama nustatant rezultatus. GKV PP KC naudoja valdymo rekomendacijas, pridedamas prie rezultatų, siųsdamas moteriai atitinkamą pranešimą dėl kito rekomenduojamo GKV PP etapo. |
| Kokybės reikalavimas |
Terminas |
| Rezultato patikrinimas ir rekomendacija |
|
| Siekiant sumažinti GKV PP klaidų riziką, prieš patvirtinant gautus rezultatus atliekamas nepriklausomas atvejų rezultato ir jų valdymo proceso patikrinimas, atsitiktinai atrinktų 10 proc. mėginių. |
| Kokybės reikalavimas |
Terminas |
| Rezultatų patvirtinimas |
|
| Kiekvienas rezultatas prieš paskelbimą tinkamai patvirtinamas. Prieš patvirtinant, patikrinama ar ataskaitose nėra neatitikimų. Ataskaitose nurodomas tyrėjas pateikęs tyrimo išvadą. |
| Kokybės reikalavimas |
Terminas |
| Tyrimo rezultato pranešimas programai |
|
| Tyrimo rezultatai paskelbiami suderintu formatu elektroninėmis priemonėmis GKV PP KC per ESPBI IS/GKV PP posistemę. |
| Standartas |
Terminas |
| Laboratorinio atsako laikas |
95 proc. per 10 darbo dienų |
| Citologiniai rezultatai patvirtinami, paskelbiami ir perduodami į ESPBI/GKV PP posistemę per tiksliai nustatytą laiką, skaičiuojamą nuo ėminio patvirtinimo programoje. |
Pastaba: jei nurodyto termino neįmanoma laikytis, apie tai reikia pranešti tyrimą užsakiusiam gydytojui.
| Kokybės reikalavimas |
Terminas |
| Rezultatų ataskaitų tinkamumas |
|
| Rezultatų tyrimų atsakymai, pateikiami tyrimą užsakiusiems gydytojams ir klinikoms, o turinys turi atitikti GKV PP rekomendacijas. |
| Standartas |
Terminas |
| Rezultatų ataskaitos tyrimą užsakiusiems gydytojams ar klinikoms pateikimas |
99 proc. turi būti gautos per 5 darbo dienas nuo tyrimo paėmimo pradžios |
| Patvirtinti ir paskelbti rezultatai pateikiami tyrimą užsakiusiam gydytojui ar klinikai. |
Pastaba: gaunant rezultatus, reikia atsižvelgti į laiką, kurio reikia atspausdintoms popierinėms rezultatų formoms pristatyti (paštu ar kurjeriu), kad būtų pasiektas pristatymo tyrimą užsakiusiam gydytojui ar klinikai tikslas.
| Kokybės reikalavimas |
Terminas |
| Rezultatų ataskaitų pristatymas tyrimą užsakiusiems gydytojams ar klinikoms |
|
| Rezultatų ataskaitos pateikiamos atitinkamam tyrimą užsakiusiam gydytojui ar klinikai. Siekiant užtikrinti, kad rezultatai būtų išsiųsti atitinkamam gydytojui, reikia atlikti dokumentais pagrįstus valdymo procesus ir pašalinti gautų mėginių ir perduotų ataskaitų skaičiaus neatitikimus. |
| Kokybės reikalavimas |
Terminas |
| Rezultatų ataskaitų teikimas elektroninėmis priemonėmis |
|
| Pageidautina, kad visos GKV PP rezultatų ataskaitos būtų pateikiamos automatiškai tyrimą užsakiusiems gydytojams ar klinikoms per ESPBI IS/GKV PP posistemę. |
Saugojimas ir archyvavimas
| Kokybės reikalavimas |
Terminas |
| Prieiga prie duomenų |
|
| Jei prašoma, laboratorijos suteikia GKV PP KC prieigą prie duomenų, įskaitant žurnalus ir įrašus. |
Kokybės užtikrinimas ir nuolatinis tobulinimas
| Kokybės reikalavimas |
Terminas |
| Išorinis kokybės vertinimas |
|
| Visos laboratorijos, dalyvaujančios GKV PP ir atliekančios citologinius ir ŽPV tyrimus, dalyvauja išorės kokybės vertinimo programoje, pagal GKV PP kokybės rodiklių užtikrinimo rekomendacijas. |
| Standartas |
Terminas |
| Kokybės rodikliai |
Duomenys pildomi bent kartą per ketvirtį, per mėnesį nuo laikotarpio pabaigos |
| GKV PP KC reguliariai teikiamos išsamios ir tikslios gautų rezultatų ataskaitos su nustatytais kokybės rodikliais, kurie nurodyti GKV PP kokybės rodiklių užtikrinimo rekomendacijose. |
Pastaba: kokybės rodikliai, surinkti atliekant vidaus kokybės kontrolės procedūras, naudojami stebėjimo, vertinimo, ataskaitų teikimo, apžvalgos ir grįžtamojo ryšio tikslams.
Reikiami kokybės rodikliai apima priemones, kurias turėtų būti galima lengvai gauti iš laboratorijų vidaus kokybės kontrolės procesų. Laboratorijos statistikos ir stebėjimo tikslais turi galimybę atskirti GKV PP darbo krūvį nuo kitų darbo krūvių.
| Kokybės reikalavimas |
Terminas |
| Kokybės rodiklių tobulinimas |
|
| Laboratorijos laiku imasi tinkamų priemonių, kad išspręstų su GKV PP rezultatais susijusias problemas, kurios lemia kokybės rodiklius ir dėl kurių gaunamos vertės, neatitinkančios laboratorijos, nacionalinių ir (arba) tarptautinių normų. Išorės kokybės užtikrinimo programos rezultatai nuolat vertinami ir esant būtinybei nedelsiant imamasi korekcinių veiksmų dėl nepriimtinų GKV PP rezultatų. |
| Kokybės reikalavimas |
Terminas |
| Kokybės užtikrinimo vizitai |
|
| Laboratorijos priima GKV PP KK paskirtą personalą, atvykusį vizituoti vietoje kokybės stebėsenos, audito ir kitais GKV PP užtikrinimo tikslais, ir leidžia jiems naudotis savo ištekliais, procesais, dokumentais ir rezultatais. |
2.3. Gimdos kaklelio vėžio patikros programos pakvietimo proceso pagrindiniai kokybės principai
Pagrindinis organizuotų patikros programų elementas yra gyventojų informacijos sistema (gyventojų registras).
GKV PP informacinė sistema (ESPBI IS/GKV PP posistemė) turi būti sukurta taip, kad padėtų vykdyti GKV PP ir sudarytų galimybes stebėti ir vertint.* Jos funkcijos:
· nustatyti tikslinę populiaciją (visa tikslinė populiacija yra ESPBI IS/GKV PP posistemėje);
· identifikuoti atskiras tikslinės populiacijos moteris – diferencijuoti netikrinamas, tikrinamas moteris ir specialių tikslinių grupių moteris;
· leisti siųsti kiekvienai tikslinės populiacijos moteriai kvietimo dalyvauti patikroje ar priminimo dėl dalyvavimo laiškus, kai moteris sulaukia rekomenduojamo amžiaus, ir kvietimus dar kartą apsilankyti patikroje rekomenduojamu intervalu;
· suteikti išankstinio atšaukimo galimybę;
· užregistruoti patikros rezultatus ir nustatyti moteris, kurioms rekomenduojama imtis tolesnių veiksmų;
· stebėti, ar buvo imtasi rekomenduojamų veiksmų nustačius pakitimus, ir rinkti informaciją apie tolesnius tyrimus;
· užtikrinti ilgalaikį tolesnį stebėjimą gydytoms pacientėms;
· nustatyti vėžio ir mirčių atvejus visoje populiacijoje;
· suteikti galimybę, siekiant sistemingai užtikrinti kokybę, susieti pavienius patikros epizodus, vėžio ir ikivėžinius pokyčius ir palaikyti grįžtamąjį ryšį su laboratorijomis ir gydytojais.
2.3.1. Patikros programos intervalo apibūdinimas, tikslinės populiacijos identifikavimas
Už GKV PP veiklą yra atsakingas GKV PP koordinavimo centras (GKV PP KC), kuris koordinuoja su GKV PP veikla susijusių problemų sprendimą.
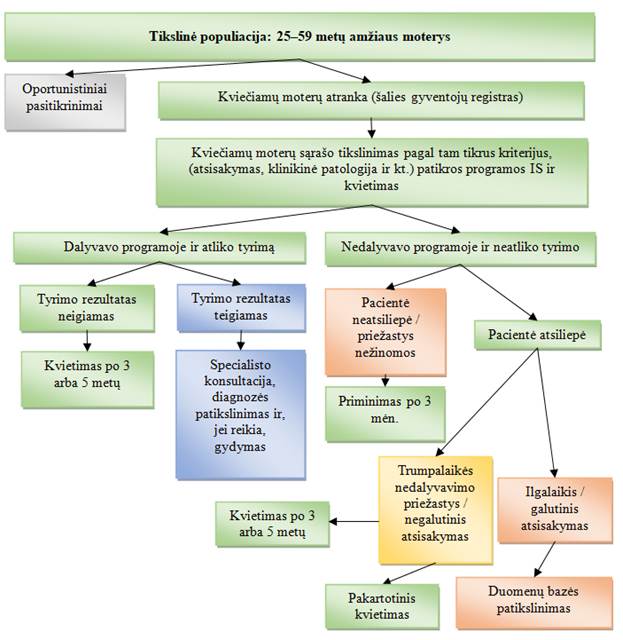
Atsižvelgiant į Europos Sąjungos rekomendacijas, Lietuvoje siūloma pagal GKV PP tikrinti 25–59 metų amžiaus moterims kas 3 metus ar 5 metus, per pirmuosius GKV PP metus pakviečiant į programą 100 proc. moterų. Siekiama, kad per metus pasitikrintų 80–90 proc. pakviestų į GKV PP moterų.
Į programą bus kviečiamos privalomuoju sveikatos draudimu draustos 25–59 metų amžiaus moterys, kurioms tais metais suėję 25 metai, bet ne daugiau kaip 60 metų ir kurios paskutinį kartą buvo kviestos dalyvauti GKV PP ne anksčiau nei prieš 3 metus ar 5 metus ir neturi gimdos kaklelio vėžio (GKV) diagnozės.**
2.3.1.1 lentelė. Tikslinės populiacijos identifikavimo kriterijai
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Ankstesnio kvietimo laikas |
Dalyvavusios GKV PP prieš > 3 metus ar 5 metus |
| Ankstesnė gimdos kaklelio intervencija |
Be TLK-10 ACHI kodo (1275-1276) iš ESPBI IS |
| Esama GKV in situ diagnozė |
Be TLK-10 kodo D06 iš ESPBI IS |
| Esama GKV diagnozė |
Be TLK-10 kodo C53 iš ESPBI IS |
| Draustumas PSD duomenų bazėje |
Taip |
Gyventojų registro tarnyba (GRT) teikia duomenis apie tikslinės populiacijos atranką pagal GKV PP KC užklausą.
* GKV PP posistemės kūrimas prie ESPBI IS yra atskiras projektas, kuris šiuo metu suspenduotas, o be šios posistemės sukūrimo ir įdiegimo į praktiką neįmanomas GKV PP KC bei pačios programos veikimas ir GKV PP koordinavimas.
** Kas liečia nedraustų moterų - šiai dienai PSD yra privaloma draustis visiems, o socialiai pažeidžiamus asmenis draudžia valstybė. Gali būti situacijų, kad savarankiškai mokanti moteris nesusimoka už praeitą mėnesį ir einamąjį mėnesį jos draudimas negalioja, kol nesumokama skola. Tai jei tą mėnesį jai kvietimas neišsiunčiamas, gal jį kartoti po 3 (arba po 6?) mėnesių kaip ir į kvietimus neatsiliepusioms moterims? Nedraustumo situacija neturėtų ilgai tęstis - skola yra greitai nurašoma nuo sąskaitos. Je nėra iš ko nurašyti, moteris dėl vienokių ar kitokų priežasčių turėtų papulti į valstybės draudžiamų asmenų grupę.
2.3.1.2 lentelė. Į GKV PP kviečiamų asmenų įtraukimo kriterijai iš GRT duomenų bazės
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Asmens kodas |
Taip (11 skaitmenų) |
| Vardas |
Taip |
| Pavardė |
Taip |
| Šeiminė padėtis |
Taip |
| Deklaruota gyvenamoji vieta |
Taip |
| Faktinė gyvenamoji vieta |
Taip |
| Be nuolatinės gyvenamosios vietos |
Ne |
| Išvykimas į užsienio valstybę |
Ne |
Pagal ES rekomendacijas GKV PP turėtų dalyvauti ne mažiau 80 proc. 25–59 metų amžiaus moterų.
Lietuvoje, remiantis Statistikos departamento duomenimis, 2019 m. pradžioje buvo 1 498 593 moterys, iš jų 25–59 metų amžiaus – 677 586 (45,21 proc.).
Migracijos departamentas (MD) tikslina teikiamus tikslinės populiacijos atrankos duomenis pagal GKV PP KC užklausą.
2.3.1.3 lentelė. Į GKV PP kviečiamų asmenų tikrinimo kriterijai iš Migracijos departamento duomenų bazės
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Asmens kodas |
Taip |
| Vardas |
Taip |
| Pavardė |
Taip |
| Deklaruota gyvenamoji vieta |
Taip |
| Išvykimo data |
Metai, mėnuo, diena |
Elektroninė sveikatos priežiūros ir bendradarbiavimo infrastruktūros informacinė sistema (ESPBI IS) teikia tikslinės populiacijos atrankoje dalyvaujančių asmenų gydymosi asmens sveikatos priežiūros įstaigoje (ASPĮ) duomenis pagal GKV PP KC užklausą.
2.3.1.4 lentelė. Į GKV PP kviečiamų asmenų patikslinimo kriterijai iš ESPBI IS duomenų bazės
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Asmens kodas |
Taip (11 skaitmenų) |
| Vardas |
Taip |
| Pavardė |
Taip |
| Diagnozių istorija 3 metų laikotarpiu |
Taip |
| Diagnozė pagal TLK-10 (D06) |
Taip |
| Diagnozė pagal TLK-10 (C53) |
Taip |
| Diagnozė pagal TLK-10 ACHI (1275-1276) |
Taip |
| Paskirtas gydymas 3 metų laikotarpiu |
Taip |
| Paskirtų procedūrų istorija |
Taip |
Nacionalinio vėžio instituto (NVI) Vėžio registras (VR) teikia duomenis apie tikslinės populiacijos atrankoje dalyvaujančių asmenų įtraukimą į VR duomenų bazę pagal GKV PP KC užklausą.
2.3.1.5 lentelė. Į GKV PP kviečiamų asmenų patikslinimo kriterijai iš NVI VR duomenų bazės
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Asmens kodas |
Taip (11 skaitmenų) |
| Vardas |
Taip |
| Pavardė |
Taip |
| Nustatyta diagnozė pagal TLK-10 kodus (D06) |
Taip |
| Nustatyta diagnozė pagal TLK-10 kodus (C53) |
Taip |
Mirties priežasčių registras (MPR) prie Higienos instituto (HI) teikia duomenis apie tikslinės populiacijos atrankoje dalyvaujančių asmenų įtraukimą į MPR duomenų bazę pagal GKV PP KC užklausą.
2.3.1.6 lentelė. Į GKV PP kviečiamų asmenų patikslinimo kriterijai iš MPR duomenų bazės
| Požymiai |
Kriterijai |
| Lytis |
Moteris |
| Amžius |
25–59 metų imtinai |
| Asmens kodas |
Taip (11 skaitmenų) |
| Vardas |
Taip |
| Pavardė |
Taip |
| Pagrindinė mirties priežastis pagal TLK-10 |
Taip |
25–34 metų moterys į GKV PP bus kviečiamos atlikti citologinio tyrimo ir tikrinamos kas 3 metus, o 35–59 metų moterys bus kviečiamos atlikti ŽPV tyrimo ir tikrinamos kas 5 metus.
2.3.2. Kvietimo į patikros programą tvarkaraščių, formos ir turinio metodai, principai ir užduotys
Dalyvauti GKV PP moterys kviečiamos šiais metodais: laiškais (siunčiami paštu), el. laiškais ir E. sveikata (ESPBI IS/GKV PP posistemė) sistemoje.
Už moterų kvietimo (laiškais, el. laiškais) dalyvauti programoje proceso įgyvendinimą atsakingi GKV PP KC. Informacija (istorija) apie tikslinės populiacijos moterų kvietimą dalyvauti programoje (kvietimus, priminimus apie kvietimą, pakartotinius kvietimus) saugoma GKV PP KC informacinėse sistemose. Kvietimo procesas apima šiuos veiksmus (2.3.2.1. pav.):
· kvietimų dalyvauti programoje (atlikti profilaktinį citologinį arba ŽPV tyrimą) ir informacinių pranešimų siuntimas. Kvietimuose nurodoma tyrimo data, laikas ir vieta (1 ir 2 priedai);
· galimas tyrimo datos ir laiko koregavimas moterims kreipiantis kvietime nurodytais kontaktais;
· priminimų dėl dalyvavimo programoje siuntimas moterims, kurios neatsiliepė į pirmąjį kvietimą (neatvykus atlikti tyrimo, siunčiami po 3 mėn.), jei moteris, kuriai buvo išsiųstas kvietimas, neatsiliepia (neatvyksta atlikti tyrimo paskirtu laiku, nepakeičia tyrimo laiko ir nesusiekia su koordinavimo centru);
· informacijos apie kvietimą dalyvauti programoje paskelbimas e. sveikatos sistemoje;
· pakartotinis kvietimas dalyvauti po 3 (25–34 m. moterims) arba 5 (35–59 m. moterims) metų, jei su moterimi nepavyko susiekti ir laikoma, kad moteris nedalyvauja tame programos cikle. Jei yra galimybė, kontaktinės informacijos tikslinimas duomenų bazėje;
· informacijos apie trumpalaikio atsisakymo priežastis tikslinimas, jei moteris atsiliepia į kvietimą, ir pakartotinis kvietimas po 3 (25–34 m. moterims) arba 5 (35–59 m. moterims) metų. Jei moteris visiškai atsisako dalyvauti programoje, jai kvietimai nebesiunčiami;
· pakartotinių kvietimų kas 3 metus (25–34 m. moterims) arba kas 5 metus (35–59 m. moterims) siuntimas moterims, kurios anksčiau dalyvavo programoje ir kurių tyrimų rezultatai buvo neigiami;
· koordinavimo centro bendradarbiavimas su ASPĮ sudarant tyrimų tvarkaraščius, paskiriant datas, laiką ir specialistus, kurie nurodyti siunčiamuose kvietimuose. Tai daroma naudojantis išankstinio pacientų registravimo sistema;
· laiškų, kuriuose pateikiami profilaktinio įprastinio citologinio arba ŽPV tyrimo rezultatai (atsakymas) ir rekomendacijos, kokių veiksmų, atsižvelgiant į tyrimo rezultatus, turi imtis atrankinės patikros programoje dalyvaujanti moteris, siuntimas (3–7 priedai). Tyrimo rezultatai, gavus moters sutikimą imant tyrimo ėminį, pateikiami siunčiant laišką į namus arba el. laišką. Tyrimo rezultatai taip pat paskelbiami e. sveikatos sistemoje. Laiškai siunčiami siekiant užtikrinti tinkamą moterų, kurioms profilaktiniu citologiniu ar ŽPV tyrimu nustatyta pokyčių, stebėjimą ir tolesnę priežiūrą.
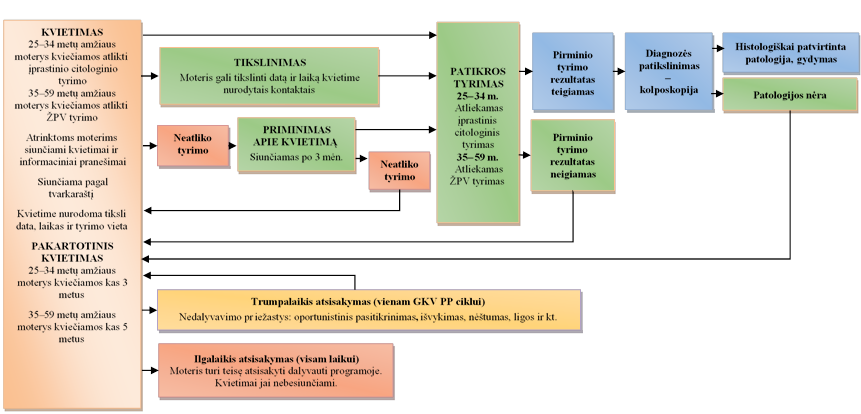
2.3.2.1 pav. Kvietimo proceso schema
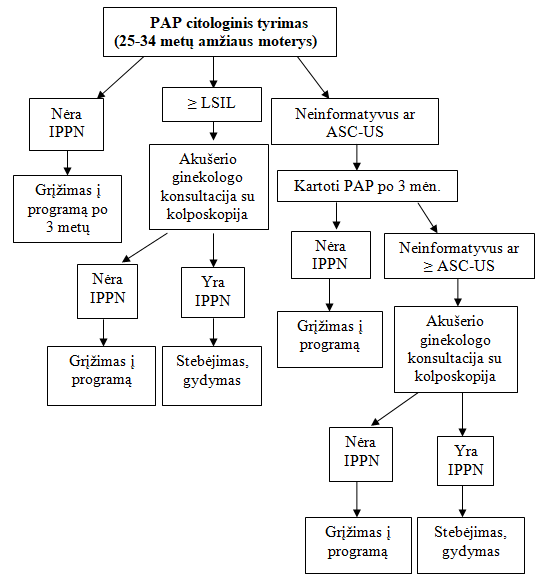
2.3.2.3. pav. Žmogaus papilomos viruso (ŽPV) profilaktinio tyrimo algoritmas
Dalyvauti atrankinės patikros programoje moterys kviečiamos laikantis šių kokybės reikalavimų:
· Svarbios informacijos teikimas moterims (pakvietimuose, informaciniame pranešime ir kituose šaltiniuose)
Moterims (įskaitant turinčias specialiųjų poreikių) teikiama tinkamo formato informacija, kuri padėtų priimti sprendimus, susijusius su dalyvavimu programoje. Informacinė medžiaga periodiškai peržiūrima ir atnaujinama atsižvelgiant į politikos pokyčius ir vartotojų poreikius. Informacija turi būti pagrįsta mokslu, tiksli, aiški ir nauja.
· Tinkamas informacijos siuntimas moterims
Prie kvietimų ir laiškų su rezultatais pridedami tinkami informaciniai pranešimai. Informaciniame pranešime ir laiške pateikiama informacija apie programą, rekomendacijos ir nurodomi tolesni veiksmai, atsižvelgiant į tyrimų rezultatus.
· Registracijos galimybės
Moterims suteikiama galimybė užsiregistruoti dalyvauti atrankinės patikros programoje (dėl profilaktinio citologinio arba ŽPV tyrimo), pasitikrinti registraciją, atnaujinti savo registracijos duomenis ir patikrinti galimybes dalyvauti programoje (telefonu, paštu ar internetu). Kvietime ir informaciniame pranešime nurodomi būdai, kuriais tai galima padaryti, ir kontaktai.
· Moterys, turinčios specialiųjų poreikių
Galimybės dalyvauti atrankinės patikros programoje užtikrinamos ir moterims, turinčioms specialiųjų poreikių. Savivaldybėje turi būti akušeris-ginekologas, kuris užtikrintų, kad tyrimas būtų atliekamas ir specialiųjų poreikių turinčioms moterims.
· Moterų atsiliepimai ir grįžtamasis ryšys
Programoje turi būti numatytos tinkamos priemonės, kad moterys galėtų pateikti atsiliepimus, susijusius su dalyvavimu atrankinės patikros programoje. Grįžtamasis ryšys teikiamas telefonu, el. paštu, paštu, raštu ir kt. Telefonai, el. pašto adresai ir interneto svetainės adresas nurodomi kvietime ir informaciniame pranešime.
· Moterų atsisakymas dalyvauti programoje
Moterims, kurios nusprendžia nedalyvauti programoje, yra numatyta atsisakymo procedūra. Moterys gali atsisakyti tiesiogiai apie tai pranešdamos koordinavimo centrui, kurio kontaktai pateikti kvietime, informaciniame pranešime ir koordinavimo centro interneto svetainėje.
Kvietimo proceso efektyvaus vykdymo tikslinimo principai (adresų tikslinimas, migracija, mirčių registras, draustumas)
Pakviestai moteriai neatvykus į GKV PP, tikslinamas jos adresas tiek GRT, tiek ESPBI IS, pakartotinai tikrinama būsena MD duomenų bazėje, VR duomenų bazėje ir MPR duomenų bazėje.
ESPBI IS tikrinama neatvykusios į GKV PP moters deklaruotoji ir faktinė gyvenamosios vietos patikslinant adresą GRT.
Kvietimų tvarkaraščio sudarymo principai
· Kiekviena ASPĮ dalyvaujanti GKV PP turi būti prijungta prie ESPBI IS.
· GKV PP kvietimo tvarkaraščius ASPĮ sudaro per ESPBI IS sistemą, palaikančią ryšį su ESPBI IS posisteme, kurioje yra visa kviečiamų į GKV PP moterų duomenų bazė su reikalingais GKV PP funkcionuoti požymiais.
· GKV PP KC per ESPBI IS posistemės duomenų bazę automatiškai priskiria pakviestą moterį ESPBI IS prie konkrečios ASPĮ, kurioje ji yra prisirašiusi (priregistruota), tyrimo paėmimui.
· ESPBI IS duomenų bazėje pakviesta moteris įtraukiama į patikros tyrimo paėmimo išankstinės registracijos tvarkaraštį ASPĮ. Kviečiamos 2 moterys tuo pačiu laiku.
· Vienam vizitui ASPĮ išankstinės registracijos tvarkaraštyje dėl GKV PP nustatytų tikslų skiriama 20 min.
· Vidutiniškai per dieną skiriamų 100 min. laiko GKV PP dalyvaujančių moterų patikrinimui, per dieną pakviečiant į ASPĮ po 10 moterų, vienai moters patikrai skiriant 20 min.
2.3.2.1 lentelė. Atrinktų į GKV PP moterų įtraukimo į ESPBI IS duomenų bazės išankstinės registracijos tvarkaraštį kriterijai
| Požymiai |
Kriterijai |
| Vardas |
Taip |
| Pavardė |
Taip |
| Asmens kodas |
Taip |
| Deklaruota gyvenamoji vieta |
Adresas (pašto kodas, gatvė, namo Nr., miestas) |
| Kvietimo data |
Metai, mėnuo, diena |
| Kvietimo laikas |
Valanda ir minutės |
| Asmens sveikatos priežiūros įstaiga |
Taip (ASPĮ pavadinimas) |
| Telefono Nr. (mobiliojo ar laidinio) |
Taip |
| El. pašto adresas |
Taip |
Kvietimo ir priminimo apie kvietimą formos ir turinio principai (fizinis arba elektroninis metodas)
Kvietimas rengiamas remiantis šiais kokybės reikalavimais:
· prieinamumas: informacija turi būti lengvai randama ir pasiekiama;
· aktualumas: informacija turi būti „orientuota į moteris“ ir apimti dalykus, kuriuos moterys norėtų sužinoti;
· suprantamumas: informacija turi būti aiški, vengiama profesinio žargono ir techninės (profesinės) kalbos;
· visapusiškumas: informacija turi apimti ir teigiamus, ir neigiamus atrankinės patikros programos bei citologinio tyrimo aspektus;
· pritaikymas: informacija turi būti pritaikyta pagal skirtingų grupių poreikius ir skirtingas situacijas;
· etapo specifiškumas: informacija turi atitikti skirtingus atrankinės patikros programos etapus (kvietimas, tyrimo rezultatai, tolesni veiksmai atsižvelgiant į tyrimų rezultatus ir kt.);
· daugiapakopiškumas: informacija turi būti teikiama pradedant nuo pagrindinės (bendrosios) informacijos, vėliau pereinant prie išsamesnės informacijos apie konkrečius atrankinės patikros programos aspektus ir skirtingais formatais, atsižvelgiant į skirtingų grupių poreikius.
Kvietimo formos ir turinio kokybės reikalavimai:
· atrankinės patikros programos tikslas: kam skirta programa (tikslinė populiacija 25–59 metų moterys) ir ko ja siekiama;
· informacija apie citologinį ar ŽPV tyrimą, kuris bus atliekamas;
· patikros programos intervalas (3 arba 5 metai, jei prieš tai nebuvo pokyčių);
· ar programa yra nemokama;
· vizitas pas gydytoją (dėl citologinio arba ŽPV tyrimo) – tiksli data, laikas ir vieta, kur moteris kviečiama atlikti tyrimo;
· informacija, kaip būtų galima pakeisti vizito laiką;
· informacija apie tai, kada galima tikėtis tyrimo rezultatų ir kaip jie bus perduodami pacientei;
· informacija apie tikimybę, kad atliekant tyrimą gali būti nustatoma pokyčių arba tyrimo rezultatai gali būti netinkami, ir apie tolesnę priežiūrą;
· patikros testo tinkamumas paskirčiai (validumas);
· papildoma informacija apie tyrimą – rekomendacijos prieš tyrimo atlikimą;
· nuorodos, kur moteris gali gauti papildomos informacijos, susijusios su atrankinės patikros programa ir citologiniu ar ŽPV tyrimu – kontaktai, internetinės nuorodos ir kt.;
· duomenų apsauga ir konfidencialumas.
2.3.2.1. Atsakymo apie nustatytus radinius vertinimo kriterijai
Per 14 darbo dienų atsakymai apie GKV PP metu nustatytus gimdos kaklelio pokyčius ir kitus radinius siunčiami paštu ir įkeliami į ESPBI IS GKV PP posistemę, prie kurios vartotojui suteikiama asmeninė prieiga. Atsakymų variantai gali būti trys:
1) viskas gerai (norma) – šios moterys pakartotinai į GKV PP bus kviečiamos po 3 (25–34 metų moterys) arba po 5 (35–59 metų moterys) metų;
2) tyrimą reikia kartoti – tyrimas netinkamas analizei arba nustatytas ASC-US kriterijus; Moterims siunčiamas laiškas, kuriame nurodoma kito (kartotinio) tyrimo data, laikas ir vieta. Kartotinis tyrimas skiriamas ne anksčiau kaip po 3 mėn.;
3) tyrimo rezultatai patologiniai – įtariamos ikivėžinės būklės gimdos kaklelio pokyčiai. Moterims siunčiamas laiškas, kuriame nurodoma išsamaus diagnostinio tyrimo data, laikas ir vieta. Nustačius ASC-US ar HSIL moteris per ESPBI IS/GKV PP posistemę IPR sistemą užregistruojama kolposkopiniam tyrimui į artimiausią ASPĮ teikiančią kolposkopijos paslaugą ir tuo pačiu pranešimas išsiunčiamas PSPĮ moterį prižiūrinčiam ŠG.
2.3.3. Komunikacijos su ištirtomis moterimis po pirminio citologinio ar ŽPV tyrimo principai (atrankos ir informavimo principai, forma ir turinys)
Moterų asmeninės ir sveikatos informacijos saugojimas, prieiga prie jos ir perdavimas turi atitikti ES bendrąjį duomenų apsaugos reglamentą.
Moters patikros istoriją sudaro informacija, kuri yra Gimdos kaklelio citologinio ir ŽPV tyrimo formoje (žiūrėti III skyriaus priedą Nr.1). ir kuri saugojama ESPBI IS/GKV PP posistemėje.
Kiekviena moteris tinkamai žodžiu ar raštu informuojama apie patikros tyrimo rezultatą.
Nerimą gali sukelti vien gimdos kaklelio patikra ir rasti pokyčiai, dėl kurių reikia siųsti atlikti kolposkopijos ar gydyti.
1. Kiekviena moteris turi gauti žodinę ir (arba) rašytinę informaciją prieš gimdos kaklelio tepinėlio ėmimą ir po jo. Jai nurodoma, kad bus informuojama apie rezultatą žodžiu (prireikus – telefonu) arba raštu.
4. Moteris turi gauti tinkamai surašytą kvietimą atlikti kolposkopiją, kuriame nurodomas kontaktinis asmuo, telefono numeris ir klinikos darbo laikas.
5. Per kolposkopijos vizitą asmuo, atliekantis kolposkopinį tyrimą, turi suteikti pacientei žodinę informaciją. Nurodoma, kad tyrimų rezultatai bus pranešti per kelias savaites.
6. Jei vizitas į kolposkopijos kliniką susijęs su gydymu, pacientei per kelias savaites pranešama apie ekscizinės biopsijos ar perforacinės biopsijos histologinius rezultatus.
2.3.4. Grįžtamojo ryšio su specialistų ištirtomis moterimis principai
Laboratorijos, dalyvaujančios GKV PP, pateikia atitinkamą klinikinę informaciją ir tolesnius duomenis kitoms programoje dalyvaujančioms laboratorijoms.
Mėginių ėmėjai kasmet informuojami apie mažesnio nei patenkinamo lygio ar nepatenkinamo lygio ląstelių mėginių procentą, palyginti su vidutine šalies, regiono ar laboratorijos procentine dalimi. Mėginių ėmėjai pateikia pagrindinę informaciją naudodamiesi standartine prašymo forma.
Ginekologai pateikia atitinkamą klinikinę informaciją ir tolesnius duomenis laboratorijoms, dalyvaujančioms gimdos kaklelio patikros programoje.
Citologiniai ir histologiniai įrašai reguliariai siunčiami GKV PP KC, atsakingam už patikros programų stebėseną. Ši sąlyga privaloma ir apima visus įrašus, neatsižvelgiant į tyrimo indikacijas, moters statusą, tepinėlio ėmėją ar laboratoriją. Laboratorijos turi gauti ataskaitas su patikrinimo proceso rezultatais ir poveikio vertinimu.
GKV PP KC gali teikti dalyvaujančioms laboratorijoms konkrečią ir bendrąją statistiką.
2.3.5. Patikros programoje dalyvavusių tiriamųjų duomenų perdavimo į PASPC per ESPBI IS/GKV PP posistemę principai
Informacija apie GKV PP dalyvavusių moterų duomenis į PASPC perduodama elektroniniu (skaitmeniniu) būdu per ESPBI IS/GKV PP posistemę. Kiekvieną mėnesį ESPBI IS/GKV PP posistemė generuoja ataskaitas apie GKV PP dalyvavusias moteris, rastus pokyčius, pakartotinius kvietimus atvykti tirtis pas gydytojus specialistus ar atlikti kitų procedūrų. Tai gali atlikti tik tos PASPC, kurios yra prisiregistravusios ESPBI IS/GKV PP posistemėje ir sudariusios sutartis. PASPC turi būti įgyvendinusi visas jungimosi prie ESPBI IS/GKV PP posistemės saugumo procedūras.
2.4. Oportunistinio pasitikrinimo apibūdinimas
Dalis citologinių gimdos kaklelio tyrimų atliekama pacientėms savarankiškai kreipiantis dėl tyrimo arba moterims atvykus į gydytojo konsultaciją ir jam rekomendavus ar paskyrus. Tokie tyrimai atliekami ne pagal atrankinės patikros programą ir vadinami oportunistiniais.
Dažniausiai šie tyrimai atliekami privačiose sveikatos priežiūros įstaigose ar įstaigose, teikiančiose specializuotas asmens sveikatos priežiūros paslaugas. Šios paslaugos nėra apmokamos pagal Gimdos kaklelio piktybinių navikų prevencinių priemonių, apmokamų iš Privalomojo sveikatos draudimo fondo biudžeto lėšų, finansavimo programą. Tai gali būti įprastinis citologinis tyrimas, skiriamas ne pagal programą, skystų terpių citologinis tyrimas arba ŽPV tyrimas.
Rekomenduojama vengti oportunistinių tyrimų. Oportunistiniai tyrimai atliekami per dažnai arba, priešingai, nepakankamai dažnai. Oportunistinėms patikroms būdingi vykdymo netolygumai tarp gyventojų grupių, kurios skiriasi socioekonomine padėtimi, gyvenamąja vieta ir kt. veiksniais. Be to, jos sukelia papildomą ekonominę naštą valstybei, jeigu moteriai tyrimas atliekamas įstaigoje, teikiančioje antrinio arba tretinio lygio asmens sveikatos priežiūros paslaugas.
Kai oportunistinių patikrų išvengti nepavyksta, svarbu užtikrinti, kad šie tyrimai būtų registruoti ESPBI IS/GKV PP posistemėje pagal informaciją iš profilaktinius tyrimus vertinusių laboratorijų.
2.5. Asmens sutikimo dalyvauti patikros programoje formos ir turinio principai
Kokybinis reikalavimas. Informuotas sutikimas (dėl moters patikros istorijos)
Duomenys, susiję su moters patikros istorija, renkami tik tada, jei moteris pateikė informuotą sutikimą.
Moters sutikimas leidžia jos patikros istorija, esančia registre, dalytis su trečiųjų šalių paslaugų teikėjais, įskaitant citologijos ir histologijos laboratorijas, kolposkopijos paslaugas teikiančias įstaigas.
Kokybinis reikalavimas. Informuotas sutikimas (prieš patikrą)
Moteris turi duoti informuotą sutikimą dalyvauti patikroje. Šis sutikimas turi būti pasirašytas sutikimo formoje (8 priedas). Šis sutikimas yra teisinis reikalavimas, kuris leidžia informaciją apie moterį saugoti ESPBI IS/GKV PP posistemėje ir perduoti GKV PP paslaugų teikėjams ir Nacionaliniam vėžio registrui.
Trečioji šalis niekada negali duoti sutikimo už moterį dalyvauti programoje. Moteris gali atšaukti sutikimą dalyvauti programoje kreipdamasi į GKV PP KC. Moteris gali atsisakyti dalyvauti programoje.
Kai moteris dėl kokių nors priežasčių negali pateikti informuoto sutikimo arba gydytojas nusprendžia, kad moteriai GKV PP nėra reikalinga, jokia informacija jai nesiunčiama.
2.6. Atlikto profilaktinio tyrimo (citologinio ar ŽPV) rezultatų registravimo (laboratorijoje) formos ir turinio principai
Laboratorijoje turi funkcionuoti tinkama elektroninė ataskaitų teikimo sistema ir būti lengvai prieinama visiems laboratorijos darbuotojams.
Laboratorijoje gauti duomenys registruojami mėginio siuntimo formoje (F 014-1-1/a).
Formoje nurodomi šie duomenys:
11) asmens ar asmenų, kurie įvertino mėginį, vardas ir pavardė.
Pagal IS taikomus reikalavimus ESPBI IS/GKV PP posistemė ir laboratorijų informacinė sistema (LIS) turi:
· susieti kelis tos pačios pacientės tyrimų rezultatus;
· suteikti lengvą prieigą prie informacijos apie ankstesnius pacientės gimdos kaklelio citologinių ir histologinių tyrimų rezultatus;
· apimti citologinių tyrimų klinikinių rezultatų, įskaitant kolposkopijos duomenis, biopsijas ir biopsijų neatlikimo priežastis, nustatymo ir registravimo mechanizmą;
· pateikti duomenis, reikalingus gyventojų atrankos programai įvertinti.
Visi išvardyti įrašyti ar pasirinkti duomenys remiantis galiojančiais teisės aktais persiunčiami į Nacionalinį vėžio registrą, taip pat laikomi ESPBI IS/GKV PP posistemėje, kad būtų galima juos įvertinti.
1. Tikslinės populiacijos aprėptis kvietimais – tikslinės populiacijos, kuriai per patikros intervalą siunčiami kvietimai, dalis
1.1. Kvietimas atlikti citologinio tyrimo. Per numatytą laikotarpį pakviestų dalyvauti patikroje moterų skaičius (per 3 metus) / tikslinės populiacijos moterų skaičius (25–34 metų amžiaus)
| Per 3 metus pakviestų moterų skaičius |
| Moterų skaičius tikslinėje populiacijoje |
1.2. Kvietimas atlikti ŽPV tyrimo. Per numatytą laikotarpį pakviestų dalyvauti patikroje moterų skaičius (per 5 metus) / tikslinės populiacijos moterų skaičius (35–59 metų amžiaus)
| Per 5 metus pakviestų moterų skaičius |
| Moterų skaičius tikslinėje populiacijoje |
Pastabos:
· Laikotarpį atitinka intervalas tarp dviejų neigiamų citologinių tyrimų rezultatų.
· Rekomenduojama stratifikacija pagal 3 arba 5 metų laikotarpio amžiaus grupes.
· Trumpalaikio stebėjimo rodikliai gali būti skaičiuojami pagal naujausiais kalendoriniais metais pakviestas moteris, kurios dalyvavo patikroje.
· Vertinant rodiklį svarbu atkreipti dėmesį į tai, ar programoje kviečiamos dalyvauti visos, ar atrinktos pagal tam tikrus kriterijus moterys.
· Rodiklį galima skaičiuoti atskiroms savivaldybėms ar regionams.
2. Tyrimų tikslinės populiacijos aprėptis – bent kartą per patikros intervalą ištirtų moterų dalis
2.1. Citologinių tyrimų tikslinės populiacijos aprėptis. Moterų, kurios per numatytą laikotarpį (3 metus) dalyvavo patikroje, skaičius / tikslinės populiacijos moterų skaičius (25–34 metų amžiaus)
| Moterų, kurioms bent kartą per 3 metus atliktas citologinis tyrimas, skaičius |
| Moterų skaičius tikslinėje populiacijoje |
2.2. ŽPV tyrimo tikslinės populiacijos aprėptis. Moterų, kurios per numatytą laikotarpį (5 metus) dalyvavo patikroje, skaičius / tikslinės populiacijos moterų skaičius (35–59 metų amžiaus)
| Moterų, kurioms bent kartą per 5 metus atliktas ŽPV tyrimas, skaičius |
| Moterų skaičius tikslinėje populiacijoje |
Pastabos:
· Rekomenduojama stratifikacija pagal 3 arba 5 metų laikotarpių amžiaus grupes;
· Rodiklį galima skaičiuoti atskiroms savivaldybėms ar regionams.
3. Atsiliepimas į kvietimą kaip dalyvavimo rodiklis – pakviestų moterų, kurios dalyvavo programoje, dalis
3.1. Dalyvavimo rodiklis (citologinio tyrimo). Moterų, kurios per numatytą laikotarpį (3 metus) dalyvavo patikroje, skaičius / moterų, kurios buvo pakviestos dalyvauti patikroje, skaičius
| Moterų, kurios per 3 metus buvo pakviestos dalyvauti programoje ir kurioms atliktas citologinis tyrimas, skaičius |
| 25–34 metų amžiaus moterų, kurios buvo pakviestos dalyvauti patikroje, skaičius |
3.2. Dalyvavimo rodiklis (ŽPV tyrimo). Moterų, kurios per numatytą laikotarpį (5 metus) dalyvavo patikroje, skaičius / moterų, kurios buvo pakviestos dalyvauti patikroje, skaičius
| Moterų, kurios per 5 metus buvo pakviestos dalyvauti programoje ir kurioms buvo atliktas ŽPV tyrimas, skaičius |
| 35–59 metų amžiaus moterų, kurios buvo pakviestos dalyvauti patikroje, skaičius |
Pastabos:
· Pasibaigus 3 arba 5 metų patikros intervalui, rekomenduojama skirti 6 mėnesių laikotarpį tame patikros intervale dalyvavusių moterų skaičiui įvertinti
4. Tyrimų sunaudojimas
4.1. Paimtų citologinių tyrimų skaičius. Patikroje dalyvavusių moterų pasiskirstymas pagal citologinių tyrimų skaičių tuo pačiu laikotarpiu.
| Per 3 metus tikslinėje populiacijoje atliktų citologinių tyrimų skaičius |
| Per tą patį laikotarpį patikroje dalyvavusių 25–34 metų amžiaus moterų skaičius |
4.2. Paimtų ŽPV tyrimų skaičius. Patikroje dalyvavusių moterų pasiskirstymas pagal ŽPV tyrimų skaičių tuo pačiu laikotarpiu.
| Per 5 metus tikslinėje populiacijoje atliktų ŽPV tyrimų skaičius |
| Per tą patį laikotarpį patikroje dalyvavusių 35–59 metų amžiaus moterų skaičius |
Pastabos: Įtraukti tik patikros programos tyrimus (ne pakartotinius tyrimus, pavyzdžiui, neinformatyvius ar tolesnės stebėsenos metu atliktus tyrimus) ir skaičiuoti vieną tyrimą patikros epizodui.
5. Sergamumas invaziniu vėžiu tarp nepatikrintų ir nepakankamai patikrintų moterų per tam tikrą laikotarpį
5.1. Taikant citologinį tyrimą (3,5 metų laikotarpiu)
| Invazinių vėžio atvejų, nustatytų patikroje nedalyvavusioms moterims per 3,5 metų, skaičius |
| Moterų, nedalyvavusių patikros programoje, asmens gyvenimo metai tuo pačiu laikotarpiu |
5.2. Taikant ŽPV tyrimą (5,5 metų laikotarpiu)
| Invazinių vėžio atvejų, nustatytų patikroje nedalyvavusioms moterims per 5,5 metų, skaičius |
| Moterų, nedalyvavusių patikros programoje, asmens gyvenimo metai tuo pačiu laikotarpiu |
Pastabos:
· Būtina sąsaja su Vėžio registro duomenų baze (registruotais vėžio atvejais).
· Įtraukti tik visiškai invazinius vėžio atvejus ir asmens gyvenimo metus moterų, kurios reguliariai (pagal numatytą patikros intervalą) nedalyvavo patikroje (pavyzdžiui, moterys, kurios nedalyvavo patikroje per paskutinius 3,5 ar 5,5 metų).
· Susieti patikros programos ir vėžio registrų duomenis ir apskaičiuoti pagal amžių standartizuotą paplitimą ir paplitimą pagal amžiaus grupes.
· Analizuoti pagal vėžio morfologiją.
· Skaičiuoti atskirai: a) niekada patikroje nedalyvavusių moterų; b) moterų, kurios patikroje dalyvavo daugiau nei prieš 3,5 ar 5,5 metų; c) moterų, kurios niekada nebuvo kviestos dalyvauti patikroje; d) palyginti kviestų ir nekviestų dalyvauti patikroje moterų rodiklius per atitinkamą patikros intervalą.
6. Kasmetinis moterų kvietimas (siekiama pakviesti 100 proc., minimumas – 90 proc. per 1 metus)
Kviečiamos moterys – moterys, kurioms tais metais suėjo 25 metai arba kurios paskutinį kartą kviestos dalyvauti programoje prieš 3 metus ar dalyvavo programoje prieš 3 metus (atliktas įprastinis citologinis tyrimas prieš 3 metus). Kasmet vykdoma kviečiamų moterų atranka ir kvietimas (papildomi kviečiamų moterų kriterijai aprašyti 2.2.5.2.1 dalyje).
7. Kasmetinis moterų kvietimas (siekiama pakviesti 100 proc., minimumas – 90 proc. per 1 metus)
Kviečiamos moterys – moterys, kurioms tais metais suėjo 35 metai arba kurios paskutinį kartą kviestos dalyvauti programoje prieš 5 metus ar dalyvavo programoje prieš 5 metus (atliktas ŽPV tyrimas prieš 5 metus). Kasmet vykdoma kviečiamų moterų atranka ir kvietimas (papildomi kviečiamų moterų kriterijai aprašyti 2.2.5.2.1 dalyje).
8. Priminimas apie kvietimą (siekiama pakviesti 100 proc., minimumas – 90 proc. moterų per 3 mėnesius nuo pirmojo kvietimo)
Priminimai siunčiami moterims, kurios neatsiliepė į pirmąjį kvietimą per numatytą laiką.
9. Pakartotinis moterų kvietimas ( siekiama pakviesti 100 proc., minimumas – 90 proc.)
Prieš tai tirtų moterų (tinkamų pagal amžiaus grupę). Kviečiamos atsižvelgiant į paskutinės patikros datą.
11. Korespondencijos adresų ir kontaktinės informacijos tikslumas
Registre esanti demografinė informacija apie moteris turi būti tiksli ir nauja:
· Siekiama, kad grįžtų < 10 proc. pakvietimų (pirminių ar kartotinių).
· Siekiama, kad grįžtų < 2 proc. laiškų su rezultatais ir informacija dėl tolesnės stebėsenos ar priežiūros.
1. Patikroje dalyvavusių moterų pasiskirstymas pagal tyrimo rezultatus
1.1. Patikroje dalyvavusių moterų pasiskirstymas pagal citologinio tyrimo rezultatus
| Patikroje dalyvavusių moterų, kurioms citologiniu tyrimu patvirtinta diagnozė, skaičius |
| Patikroje dalyvavusių moterų skaičius |
1.2. Patikroje dalyvavusių moterų pasiskirstymas pagal ŽPV tyrimo rezultatus
| Patikroje dalyvavusių moterų, kurioms ŽPV tyrimu nustatyta ŽPV, skaičius |
| Patikroje dalyvavusių moterų skaičius |
Pastabos:
· Skaičiuoti bendrai ir atskirai moterų grupėms: a) įprastu patikros intervalu ir trumpesniais laikotarpiais; b) pagal dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
2. Rekomeduotų kartoti tyrimų skaičius
2.1 Rekomeduotų kartoti citologinių tyrimų skaičius
| Patikroje dalyvavusių moterų, kurioms rekomenduota pakartoti citologinį tyrimą per trumpesnį nei 3 metų laikotarpį, skaičius |
| Patikroje dalyvavusių moterų skaičius |
2.2. Rekomenduotų kartoti ŽPV tyrimų skaičius
| Patikroje dalyvavusių moterų, kurioms rekomenduota pakartoti ŽPV tyrimą per trumpesnį nei 5 metų laikotarpį, skaičius |
| Patikroje dalyvavusių moterų skaičius |
Pastabos:
· Skaičiuoti atskirai pagal: a) citologinio ir ŽPV tyrimų rezultatus, dėl kurių rekomenduota kartoti tyrimą; b) dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
3. Atsiliepimas į siuntimą atlikti pakartotinio tyrimo
3.1. Atsiliepimas į siuntimą atlikti pakartotinio citologinio tyrimo
| Moterų, kurioms pagal rekomendacijas buvo atliktas pakartotinis citologinis tyrimas, skaičius |
| Moterų, kurioms buvo rekomenduotas pakartotinis citologinis tyrimas, skaičius |
3.2. Atsiliepimas į siuntimą atlikti pakartotinio ŽPV tyrimo
| Moterų, kurioms pagal rekomendacijas buvo atliktas pakartotinis ŽPV tyrimas, skaičius |
| Moterų, kurioms buvo rekomenduotas pakartotinis ŽPV tyrimas, skaičius |
Pastabos:
· Skaičiuoti atskirai pagal: a) citologinius ir ŽPV tyrimus, kurie atlikti pagal rekomendacijas; b) dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
4. Siuntimo atlikti kolposkopijos dažnis
4.1. Siuntimo atlikti kolposkopijos po citologinio tyrimo dažnis
| Patikroje dalyvavusių moterų, siunčiamų atlikti kolposkopijos, skaičius |
| Patikroje dalyvavusių moterų skaičius |
4.2. Siuntimo atlikti kolposkopijos po ŽPV tyrimo dažnis
| Patikroje dalyvavusių moterų, siunčiamų atlikti kolposkopijos, skaičius |
| Patikroje dalyvavusių moterų skaičius |
Pastabos:
· Skaičiuoti atskirai pagal: a) citologinių ir ŽPV tyrimų rezultatus, dėl kurių atlikta kolposkopija; b) dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
· Kvietimą atlikti kolposkopijos turi gauti 100 proc. tikslinės grupės moterų, atsižvelgiant į patvirtintus algoritmus.
5. Siuntimo atlikti kolposkopijos teigiama prognostinė testo vertė
5.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms kolposkopijos metu histologiškai patvirtinta LSIL (CIN 1) skaičius |
| Patikroje dalyvavusių moterų, kurioms atlikta kolposkopija, skaičius |
5.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms kolposkopijos metu histologiškai patvirtinta LSIL (CIN 1) skaičius |
| Patikroje dalyvavusių moterų, kurioms atlikta kolposkopija, skaičius |
Pastabos:
· Jei moterų, kurioms atlikta kolposkopija, skaičius nėra žinomas, vertinti naudojant siųstų atlikti kolposkopijos moterų skaičių.
· Skaičiuoti bendrai ir atskirai pagal: a) citologinio ir histologinio tyrimų duomenis b) dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
Kvietimas atlikti kolposkopijos:
· Kvietimą atlikti kolposkopijos turi gauti 100 proc. tikslinės grupės moterų, atsižvelgiant į patvirtintus algoritmus.
· Rekomenduojama, kad su laišku informaciją apie tyrimą ir sutikimo formas gautų 100 proc. tikslinės grupės moterų (minimalus skaičius – 95 proc. tikslinės grupės moterų).
· Apie vizitą skambučiu turi būti primenama 100 proc. pakviestų moterų.
· Nurodytu laiko intervalu turi būti atliekama ne mažiau kaip 90 proc. visų kolposkopinių tyrimų.
Informavimas apie biopsijos, jei ji buvo atlikta kolposkopijos metu, mėginio tyrimo rezultatus:
· Per 4 savaičių laikotarpį nuo biopsijos dienos apie biopsinio mėginio tyrimo rezultatus turi būti informuojama daugiau kaip 90 proc. moterų.
· Per 8 savaičių laikotarpį nuo biopsijos dienos apie biopsinio mėginio tyrimo rezultatus turi būti informuojama 100 proc. moterų.
Privalomi reikalavimai:
1. Teigiama prognostinė testo vertė. Kolposkopiškai ir histologiškai ryškūs pokyčiai turi sutapti > 65 proc. atvejų.
4. >90 proc. moterų, kurioms reikalingas gydymas po biopsijos, turi būti gydomos ambulatoriškai, taikant vietinę anesteziją. Privalumas – kolposkopijos klinikos, teikiančios dienos stacionaro paslaugą.
5. Priežastys, kodėl neatlikta biopsija, kolposkopijos formos protokole turi būti įvardytos 100 proc. atvejų.
1. Citologinio tyrimo specifiškumas
| Patikroje dalyvavusių moterų, kurios nebuvo siųstos atlikti kolposkopijos, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nebuvo patvirtinta LSIL (CIN+), skaičius |
| Patikroje dalyvavusių moterų, kurių citologinio tyrimo rezultatai buvo normalūs, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nebuvo patvirtinta LSIL (CIN+), skaičius |
2. ŽPV tyrimo specifiškumas
| Patikroje dalyvavusių moterų, kurios nebuvo siųstos atlikti kolposkopijos, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nebuvo patvirtinta CIN+, skaičius |
| Patikroje dalyvavusių moterų, kurių ŽPV tyrimo rezultatai buvo normalūs, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nebuvo patvirtinta CIN+, skaičius |
Pastabos:
· Skaičiuoti bendrai ir atskirai pagal: a) citologinio tyrimo duomenis (< ASC-US, < LSIL, < HSIL); b) histologinio tyrimo duomenis HSIL (CIN1+, CIN2+, CIN3+, invazinė karcinoma); c) dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
· Testo specifiškumas negali būti skaičiuojamas naudojant tolesnės stebėsenos duomenis, nes tikrasis vardiklis nėra žinomas. Tačiau formulės turi būti naudojamos apytikriam specifiškumui skaičiuoti.
· Normalus tyrimo rezultatas reiškia, kad intraepitelinių pažaidų nenustatyta (t. y. neskiriama tolesnė stebėsena ir nesiunčiama patikslinti diagnozės)
3. LSIL (CIN+) nustatymo dažnis pagal histologinę diagnozę
3.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms histologiškai patvirtinta LSIL (CIN+), skaičius |
| Patikroje dalyvavusių moterų skaičius |
3.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms histologiškai patvirtinta LSIL (CIN+), skaičius |
| Patikroje dalyvavusių moterų skaičius |
Pastabos:
Skaičiuoti atskirai: a) pagal histologinio tyrimo duomenis HSIL (CIN1+, CIN2+, CIN3+, invazinė karcinoma); b) įprastiems (3 arba 5 metų) arba trumpesniems patikros intervalams; c) pagal dalyvavimą pradiniame ir vėlesniuose patikros intervaluose.
4. Sergamumas vėžiu, kuris moterims nustatytas po normalaus pirminio tyrimo rezultato
4.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms per 3,5 metų patikros intervalą nustatytas invazinis vėžys po normalaus citologinio tyrimo rezultato, skaičius |
| Patikroje dalyvavusių moterų asmens gyvenimo metų skaičius tuo pačiu laikotarpiu, kai citologinio tyrimo rezultatai buvo normalūs |
4.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms per 5,5 metų patikros intervalą nustatytas invazinis vėžys po normalaus ŽPV tyrimo rezultato, skaičius |
| Patikroje dalyvavusių moterų asmens gyvenimo metų skaičius tuo pačiu laikotarpiu, kai ŽPV tyrimo rezultatai buvo normalūs |
Pastabos:
· Normalūs citologinio ir ŽPV tyrimų rezultatai reiškia, kad kitas tyrimas rekomenduojamas pagal patikros intervalą (kas 3 arba 5 metai).
· Skaičiuoti tik visiškai invazinio vėžio atvejus tarp moterų, kurių citologinio ar ŽPV tyrimo rezultatai per paskutinį patikros intervalą (per 3 arba 5 metus) buvo normalūs.
· Analizuoti pagal vėžio morfologiją.
· Citologijos duomenys turi būti peržiūrimi kartu su kitų vėžiu nesergančių moterų duomenimis.
1. Atsiliepimas į siuntimą atlikti kolposkopijos
1.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms iš tikrųjų buvo atlikta kolposkopija, skaičius |
| Patikroje dalyvavusių moterų, siunčiamų atlikti kolposkopijos, skaičius |
1.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms iš tikrųjų buvo atlikta kolposkopija, skaičius |
| Patikroje dalyvavusių moterų, siunčiamų atlikti kolposkopijos, skaičius |
Pastabos:
· Skaičiuoti atskirai pagal: a) skirtingus laiko intervalus po siuntimo (3 mėnesiai arba 6 mėnesiai); b) citologinio tyrimo rezultatus, dėl kurių buvo siunčiama atlikti kolposkopijos.
· Nurodytu laiko intervalu turi būti atliekama ne mažiau kaip 90 proc. visų kolposkopinių tyrimų.
· Pakartotinis moterų kvietimas – 100 proc.
2. Didelio laipsnio intraepitelinių pokyčių gydymas
2.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Gydytų moterų, kurioms per patikrą buvo nustatyta HSIL (CIN2 arba CIN3), skaičius |
| Moterų, kurioms per patikrą buvo nustatyta HSIL (CIN2 arba CIN3), skaičius |
3. Moterų, kurioms atlikta histerektomija dėl per patikrą aptiktų intraepitelinių pokyčių, dalis (proc.)
3.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms histologiškai nustatyta LSIL (CIN) ir atlikta histerektomija, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nustatyta LSIL (CIN), skaičius |
3.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių moterų, kurioms histologiškai nustatyta LSIL (CIN) ir atlikta histerektomija, skaičius |
| Patikroje dalyvavusių moterų, kurioms histologiškai nustatyta LSIL (CIN), skaičius |
Pastabos:
· Skaičiuoti atskirai pagal histologinius rezultatus HSIL (CIN1, CIN2, CIN3).
· Atskirų atvejų tinkamumą turėtų vertinti kolegos.
4. Dėl LSIL (CIN1) gydomų moterų dalis (proc.)
4.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Moterų, kurioms per patikrą nustatyta ir gydyta patvirtintų histologiškai LSIL (CIN1), skaičius |
| Moterų, kurioms per patikrą nustatyta LSIL (CIN1), skaičius |
5. Invazinio vėžio paplitimas citologiniu tyrimu nustačius pokyčių
5.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Invazinio vėžio atvejų skaičius tarp patikroje dalyvavusių moterų, kurioms citologiniu tyrimu nustatyta pokyčių |
| Patikroje dalyvavusių moterų, kurių citologinio tyrimo rezultatai buvo normalūs, asmens gyvenimo metų skaičius |
5.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Invazinio vėžio atvejų skaičius tarp patikroje dalyvavusių moterų, kurioms ŽPV tyrimu nustatyta pokyčių |
| Patikroje dalyvavusių moterų, kurių ŽPV tyrimo rezultatai buvo normalūs, gyvenimo metų skaičius |
Pastabos:
· Įtraukti patikroje dalyvavusias moteris, kurioms: a) neatlikta kolposkopija, nors indikacijų buvo; b) kolposkopija atlikta, tačiau LSIL (CIN) nenustatyta; c) LSIL (CIN) nustatyta, tačiau negydyta; d) taikytas gydymas; e) atliekama diagnostika arba tolesnė stebėsena.
· Skaičiuoti bendrai ir atskiroms grupėms.
· Įtraukti tik visiškai invazinius vėžio atvejus.
6. Moterų, kurioms citologinis tyrimas nepatvirtino SIL diagnozės, dalis 6 mėnesius po gydymo
6.1. Patikroje naudojant citologinį tyrimą (25–34 metų amžiaus moterims)
| Patikroje dalyvavusių ir gydytų moterų, kurių citologinio tyrimo rezultatas po 6 mėn. buvo neigiamas, skaičius |
| Patikroje dalyvavusių ir gydytų moterų, kurios stebėtos 6 mėn., skaičius |
6.2. Patikroje naudojant ŽPV tyrimą (35–59 metų amžiaus moterims)
| Patikroje dalyvavusių ir gydytų moterų, kurių ŽPV tyrimo rezultatas po 6 mėn. buvo neigiamas, skaičius |
| Patikroje dalyvavusių ir gydytų moterų, kurios stebėtos 6 mėn., skaičius |
Pastabos:
· Įtraukti (į vardiklį) moteris, kurios gydytos dėl HSIL (CIN2, CIN3, CGIN) ar adenokarcinomos in situ ir po gydymo stebėtos 6 mėn.
· Įtraukti (į skaitiklį) moteris, kurių AR ŽPV tyrimo rezultatas neigiamas, jei šis tyrimas naudotas tolesnei stebėsenai.
1. Tepinėlių ėmėjų kvalifikacija – 100 proc. siekiama, kad tepinėlius imtų tik tinkamą kvalifikaciją turintys asmenys.
2. Tepinėlių ėmėjo efektyvumas – laikoma, kad kiekvieno tepinėlio ėmėjo paimtų tepinėlių, kurie nurodyti kaip nepatenkinami ar netinkami, skaičius turėtų būti mažesnis nei 1,5 karto programos laikotarpio vidurkio.
3. Eksploatacinės medžiagos – siekiama 100 proc. naudoti nepasibaigusio galiojimo tepinėlių tyrimo rinkinius ir vienkartinius skėtiklius.
4. Tikslus moters atsekamumas – siekiama tyrimo siuntimo formoje užregistruoti 100 proc. (minimaliai 95 proc.) tikslius moters duomenis, kad ją būtų galima identifikuoti.
5. Duomenų kokybė – siekiama, kad dėl informacijos netikslumo, neįskaitomumo ar išsamumo stokos siuntėjui būtų grąžinama < 1 proc. (maksimaliai < 3 proc.) siuntimo formų.
6. Ėminių išsiuntimas – siekiama 95 proc. (minimaliai 90 proc.) mėginių su siuntimo forma išsiųsti į laboratoriją per 5 darbo dienas.
7. Siuntimas atlikti kolposkopijos – siekiama, kad >90 proc. moterų, kurioms nustačius citologinių pokyčių rekomenduojama kolposkopija, būtų išsiunčiamos į konsultaciją per 14 darbo dienų.
Metodas, pagrįstas pakartotine mėginių peržiūra (kasdienė):
· greitas mėginių (žr. 4.1.8 dalį) mikroskopavimas – mėginių, kurių rezultatai iš pradžių nurodyti kaip neigiami ar neinformatyvūs, peržiūra. Santykinis pirminės peržiūros jautrumas turėtų būti ≥ 85 proc.;
· 10 proc. atsitiktinių tepinėlių, kuriuose nebuvo rasta patologijos, peržiūra. Šis metodas padeda sumažinti klaidingai neigiamų tyrimų rezultatų skaičių.
Statistinė analizė (4 kartus per metus):
6) tarplaboratorinė procentinė patologijos analizė (laboratorijos rodiklių lyginimas su kitų laboratorijų rodikliais).
| Techninio proceso ir tarpiniai rezultatai |
|
| Transformacijos zonos ląstelių buvimas |
> 80 proc. mėginių |
| Pirminės patikros jautrumas po neigiamų rezultatų ir neinformatyvių mėginių greitos peržiūros |
85–95 proc. |
| Mėginių pasiskirstymas pagal šiuos kriterijus: · HSIL (CIN2 ir CIN3) · LSIL (CIN1 ir ŽPV) ir ASCUS bei AGUS · neinformatyvūs |
· 1,6 proc. ± 0,4 · 5,5 proc. ± 1,5 · 7,0 proc. ± 2,0 |
| Teigiamas prognozinis rodiklis |
65–85 proc. |
| Koreliacija tarp citologijos ir histologijos |
|
Jautrumas = teisingai teigiami / teisingai teigiami + klaidingai neigiami rezultatai
Specifiškumas = teisingai neigiami / teisingai neigiami + klaidingai teigiami rezultatai
Teigiamas prognozinis rodiklis = teisingai teigiami / teisingai teigiami + klaidingai teigiami rezultatai
Neigiamas prognozinis rodiklis = teisingai neigiami / teisingai neigiami + klaidingai neigiami rezultatai
Klaidingai neigiamų rezultatų santykis = klaidingai neigiami / teisingai teigiami + klaidingai neigiami rezultatai
Klaidingai teigiamų rezultatų santykis = klaidingai teigiami / teisingai neigiami + klaidingai teigiami rezultatai
· Turi būti skaičiuojamas laboratorijoje atliekamų tyrimų jautrumas ir specifiškumas, teigiamas ir neigiamas prognoziniai rodikliai.
Nuolatinė mėnesinė koreliacija:
· Citologinė, histologinė, klinikinė
Citologinėje, biopsinėje medžiagoje ar kolposkopijos metu radus didelio laipsnio intraepitelinių pokyčių, turėtų būti peržiūrimi visi neigiami ar neinformatyvūs citologiniai mėginiai, paimti iš moters per paskutinius 3–5 metus, rasti pokyčiai aptariami DDK ir nustatomos neatitikimo priežastys. Visi veiksmai turi būti dokumentuojami. Radus neatitikimų, išvada pakeičiama ir apie tai informuojamas mėginį ėmęs gydytojas. Skirtingose laboratorijose atliktų tyrimų rezultatai ir mėginiai turi būti lengvai pasiekiami tiriančiam gydytojui.
· Citologinė ir ŽPV
Vidinės kontrolės rezultatai aptariami DDK.
Jei laboratorija ar patikros programoje dalyvaujanti moteris neatitinka keliamų reikalavimų, atliekama audito procedūra, kurios tikslas – patikrinti laboratorijos vidinės kokybės veiklos rodiklius. Per ateinančius metus laboratorija privalo pašalinti nustatytus trūkumus, esant reikalui suteikdama darbuotojams galimybę tobulinti įgūdžius, antraip ji negali dalyvauti patikros programoje.
Trečiųjų šalių atliekama nepriklausoma peržiūra:
Nustatytais atvejais, kai reikalinga nepriklausoma trečiosios šalies peržiūra dėl gimdos kaklelio vėžio proceso, laboratorijos pateikia visą susijusią medžiagą.
Laboratorijoje taikoma statistinė analizė:
· neinformatyvių mėginių analizė pagal gydytoją, priežastį;
· rastos patologijos procentinė analizė susiejant tyrimą su jį atlikusiu asmeniu;
· procentinė patologijos analizė;
· nuolatinė mėnesinė citologinė ir histologinė koreliacija.
2.7.7. Atliktų procedūrų kokybės įvertinimas ir standartai
Kiekvienam praktikuojančiam gydytojui, atliekančiam operacijas, turi būti periodiškai pateikiamos suvestinės ataskaitos apie jo atliktų operacijų kokybę. Ataskaitos turi būti palyginamos su kitų praktikuojančių gydytojų, teikiančių tas pačias paslaugas, ataskaitomis. Veiklos rezultatų vertinimas turi būti taikomas siekiant nustatyti žinių ir įgūdžių trūkumų turinčius asmenis, kuriems būtų naudinga tikslingesnė mokymo programa.
Turi būti skatinamas tęstinis gydytojų mokymas – dalyvavimas podiplominiuose kvalifikacijos kėlimo kursuose, seminaruose, simpoziumuose.
2.7.7.1. lentelė. Rekomenduojami kokybės rodikliai (ir siektinos rodiklių reikšmės)
| Taktika, aptikus citologinius pokyčius |
|
|
|
|
Aptikus aukšto laipsnio citologinių pokyčių, atliekama biopsija. |
95 proc. |
| Aptikus aukšto laipsnio citologinių pokyčių ir atlikus kolposkopiją, jei gydymas netaikomas, stebėjimas vykdomas kas 6 mėn., atliekant citologinį tyrimą ir kolposkopiją. Žymiemscitologiniams pokyčiams išliekant, rekomenduojamas ekscizinis gydymas |
90 proc.
|
|
| Aptikus aukšto laipsnio citologinių pokyčių, bet kolposkopiniu tyrimu įtariant žemo laipsnio pažaidą, kai kolposkopinis tyrimas tinkamas (epitelių jungtis visiškai matoma), atliekamos daugybinės biopsijos. Jei patvirtinama LSIL (CIN1) ar žemesnio laipsnio pažaida, rekomenduojamas stebėjimas kartojant citologinį tyrimą ir kolposkopiją po 6 mėn. |
90 proc. |
|
|
|
Neinformatyvus citologinis tyrimas. Procentinė dalis moterų, kurios po 2 neinformatyvių tyrimų siunčiamos atlikti kolposkopijos |
≥ 95 proc. |
| Kvietimas kolposkopijos tyrimui |
|
|
|
|
Atsižvelgiant į patvirtintus algoritmus, kvietimą atlikti kolposkopijos tyrimą turi gauti visos tikslinės grupės moterys |
100 proc. |
| Apie kolposkopijos vizitą skambučiu turi būti primenama |
100 proc. |
|
| Moterys su kvietimo laišku turi gauti informaciją apie kolposkopijos tyrimą ir sutikimo formas |
≥ 95 proc. |
|
| Kolposkopijos standartai |
|
|
|
|
Kolposkopija turi būti atliekama: · ne vėliau kaip per 2 savaites, jei įtariamas vėžys · ne vėliau kaip per 4–8 savaites, jei citologiniu tyrimu nustatyta žymių pokyčių (HSIL); · ne vėliau kaip per 12 savaičių, kai gaunami kitokie patologiniai citologinio mėginio rezultatai arba du ir daugiau CT yra netinkami vertinti. |
≥ 90 proc. |
| Kolposkopinio tyrimo metu transformacijos zonos (TZ) tipas turi būti įvertintas ir nurodytas dokumentuose |
100 proc. |
|
| Apie biopsinio mėginio tyrimo rezultatus turi būti informuojama: · Per 4 savaičių laikotarpį nuo biopsijos dienos · Per 8 savaičių laikotarpį nuo biopsijos dienos |
≥ 90 proc. 100 proc. |
|
| Priežasčių įvardinimas protokole apie neatliktą biopsiją |
100 proc. |
|
| Kolposkopiniu ir histologiniu tyrimais nustatyti žymūs pokyčiai turi sutapti (teigiama prognozinė tyrimo vertė) |
> 65 proc. |
|
| Jei yra atipinė TZ, biopsija atliekama |
> 90 proc. |
|
| Biopsiniai mėginiai turi būti tinkami histologiniam tyrimui |
> 95 proc. |
|
| Gydymo savalaikiškumas |
Moterims, kurioms biopsija patvirtinta aukšto laipsnio HSIL (CIN2, CIN3) arba AIS, turi būti gydomos (išimtis – nėščios moterys) |
> 90 proc. |
| Iki operacijos |
|
|
|
|
Atlikta kolposkopija |
100 proc. |
| Pacientės rašytinis sutikimas dėl procedūros |
100 proc. |
|
| Iki bus pradėtas chirurginis gydymas, atlikta gimdos kaklelio biopsija ir žinomas histologinio tyrimo atsakymas |
> 95 proc. |
|
| Kuomet intraepitelinės neoplazijos plotai plinta į gimdos kaklelio kanalą ir nėra matoma viršutinė transformacijos zonos riba (3 tipo transformacijos zona), atlikta ekscizinė, o ne taškinė biopsija |
> 95 proc. |
|
| Dauguma procedūrų atliekamos ambulatoriškai, taikant vietinę nejautrą |
≥ 90 proc. |
|
| Operacija (eksciziniai metodai) |
|
|
|
|
Gimdos kaklelio mėginys pašalinamas vienu fragmentu |
> 90 proc. |
| Pašalinto gimdos kaklelio mėginio storis ne mažiau kaip 7 mm, ne daugiau kaip 12 mm |
> 95 proc. |
|
| Gimdos kaklelio mėginyje nustatoma intraepitelinė neoplazija (≥CIN2) |
> 85 proc. |
|
|
|
Išpjautų gimdos kaklelio kūgio (konuso) kraštuose neturi būti randama pakitimų; |
> 80 proc. |
| Pakartotinė ekscizija |
Jei pirminė ekscizija neradikali ir negalima užtikrinti stebėjimo atliekant tinkamą citologinį ir kolposkopinį tyrimą, vyresnėms nei 50 metų pacientėms, kurioms buvo nustatyta HSIL (CIN3), ir visoms pacientėms, kurioms buvo nustatyta AIS, atliekama pakartotinė ekscizija (taip pat galima ir totalinė histerektomija) |
> 90 proc. |
| Stebėjimas po gydymo |
Ligos atsinaujinimas per 24 mėnesius po gydymo |
< 5 proc. |
| Negydytų moterų stebėjimas |
|
|
|
|
Aptikus DR ŽPV, kai citologiniai pokyčiai žemo laipsnio, o per pakartotinį tyrimą ŽPV neaptikus, moteris grąžinama į patikros programą |
> 90 proc. |
| Aptikus DR ŽPV, kai citologiniu tyrimu nustatyti nežymūs pokyčiai ir per kolposkopiją displazijos nepastebima, vykdoma kontrolė po 1 metų |
> 90 proc. |
|
| Nėščioms moterims biopsija ir gydymas atidedamas, iki moteris pagimdys, išskyrus atvejus, kai įtariamas invazinis vėžys |
> 80 proc. |
|
| Nėščiai moteriai per kolposkopiją įtarus žemo laipsnio displaziją, pakartotinė kolposkopija atliekama ne anksčiau kaip 3 mėn. po gimdymo |
> 95 proc. |
|
| Nėščiai moteriai per kolposkopiją įtarus aukšto laipsnio displaziją, pakartotinė kolposkopija atliekama antro nėštumo trimestro pabaigoje ir 3 mėnesiai po gimdymo |
> 95 proc. |
|
| Nėščiai moteriai per kolposkopiją įtarus invazinį vėžį, atliekama kylinė ar kilpinė, bet ne taškinė biopsija |
100 proc. |
2.8. GKV PP duomenų šaltiniai
GKV PP duomenų šaltiniai:
2.8.1. Gyventojų registro ir Gyventojų migracijos informacinės sistemos
GKV PP naudojamų požymių Gyventojų registro informacinėje sistemoje ir Gyventojų migracijos informacinėje sistemoje sąrašai pateikti 2.8.1.1 ir 2.8.1.2 lentelėse.
2.8.1.1. lentelė. Naudojami požymiai Gyventojų registro informacinėje sistemoje
| Požymiai |
| Lytis |
| Amžius |
| Asmens kodas |
| Vardas |
| Pavardė |
| Šeiminė padėtis |
| Deklaruota gyvenamoji vieta |
| Faktinė gyvenamoji vieta |
2.8.2. ASPĮ ir laboratorijų (LIS) informacinės sistemos
GKV PP naudojamų požymių asmens sveikatos priežiūros įstaigų ir laboratorijų informacinėse sistemose sąrašai pateikti 2.8.2.1 ir 2.8.2.1 lentelėse.
2.8.2.1 lentelė. Naudojami požymiai asmens sveikatos priežiūros įstaigų informacinėse sistemose
| Požymiai |
| Lytis |
| Amžius |
| Asmens kodas |
| Vardas |
| Pavardė |
| Šeiminė padėtis |
| Deklaruota gyvenamoji vieta |
| Faktinė gyvenamoji vieta |
2.8.3. Informacinė sistema „E. sveikata“ (ESPBI IS)
GKV PP naudojamų požymių informacinėje sistemoje „E. sveikata“ (ESPBI IS) sąrašas pateiktas 2.8.3.1 lentelėje
2.8.4. Kviečiamų ir dalyvavusių patikros programoje tiriamųjų informacinė sistema (ESPBI IS/GKV PP posistemė)
GKV PP informacinėje sistemoje (ESPBI IS/GKV PP posistemė) kaupiama individuali kiekvienos tiriamosios, dalyvaujančios GKV PP, tolesnio stebėjimo istorija. Ši posistemė turi būti susieta su Gyventojų registru (kad būtų galima kviesti moteris iš tikslinės populiacijos) ir Vėžio registru (siekiant nustatyti susirgimų vėžiu intervalus). Asmenys, atsakingi už patikros organizavimą ir vertinimą, turi įsitikinti, kad šios sąsajos yra teisiškai įmanomos, o, jei ne, siūlyti teisės aktų pakeitimus.
Į GKV PP kvietimų bylas būtina įtraukti šiuos duomenis: asmens identifikatorius; sąsajos su kvietimų įrašu; lankymasis patikrose, įskaitant laiką, vietą ir priežastį (patikra pagal kvietimą, oportunistinė patikra, stebėjimo patikra ar tyrimas dėl simptomų); klinikinė informacija; mėginio tipas (įprastinis skystų terpių citologinis tyrimas); mėginio kokybė; tyrimų laboratorija; patikros rezultatai ir rekomendacijos. Į bylas taip pat reikia įtraukti patvirtinamuosius tyrimus, įskaitant kolposkopiją ir histologinį tyrimą, ir gydymą.
Kadangi patikros skyriams ir įvairiems kitiems šios srities dalyviams taip pat reikia informacijos, kad jie galėtų vykdyti savo veiklą (pvz., konsultuotis dėl citologijos ir histologijos, pateikti grįžtamąjį ryšį tepinėlių ėmėjams, pranešti apie skyriaus ar laboratorijos veiklą patikros vykdytojui) šiuos duomenis rekomenduojama surinkti vietoje patikros padaliniuose arba laboratorijose. Duomenų saugojimą ir kokybės kontrolę turi vykdyti GKV PP KC.
GKV PP naudojamų požymių informacinės sistemos „E. sveikata“ ESPBI IS/GKV PP posistemėje sąrašas pateiktas 2.8.4.1 lentelėje.
2.8.4.1 lentelė. Naudojami požymiai ESPBI IS/GKV PP posistemėje
| Požymiai |
| Lytis |
| Amžius |
| Asmens kodas |
| Vardas |
| Pavardė |
| Sutikimas dalyvauti GKV PP |
| Kvietimo tipas: pirminis ar pakartotinis |
| Pirminio kvietimo data |
| Pakartotinio kvietimo data |
| ASPĮ tipas ir unikalus numeris |
| Gydytojo specialisto pavardė ir unikalus numeris |
| Tyrimo tipas: citologinis ar ŽPV |
| Laboratorijos unikalus numeris |
| Ėminio gavimo data |
| Ėminio unikalus numeris |
| Mėginio tyrimo atsakymo data |
| Mėginį tyrusio specialisto pavardė ir unikalus numeris |
| Mėginio tyrimo atsakymas (diagnozė pagal TLK-10) |
| Siuntimas specialistui |
| Siuntimo specialistui data |
| Patologinio tyrimo tipas: biopsija ar histologinis tyrimas |
| Laboratorijos unikalus numeris |
| Patologinio ėminio gavimo data |
| Patologinio mėginio tyrimo atsakymo data |
| Patologinį mėginį tyrusio specialisto pavardė ir unikalus numeris |
| Patologinio mėginio tyrimo atsakymas (diagnozė pagal TLK-10) |
| Paskirto gydymo tipas: ekscizija ar konizacija |
| Paskirtas gydymas |
| Paskirto gydymo data |
| Gydymą paskyrusio gydytojo pavardė ir unikalus numeris |
| Paskirtos procedūros |
| Paskirtų procedūrų data |
| Procedūras paskyrusio gydytojo pavardė ir unikalus numeris |
2.8.5. Nacionalinio vėžio instituto Vėžio registro informacinė sistema
Nacionalinio vėžio instituto Vėžio registras savo ruožtu turėtų būti susietas su Mirties priežasčių registru, kad būtų galima užbaigti vėžio registraciją ir įvertinti pacientų, kuriems diagnozuotas vėžys, išgyvenamumą. Asmenys, atsakingi už patikros organizavimą ir vertinimą, turėtų įsitikinti, kad šios sąsajos yra teisiškai įmanomos, o jei ne, siūlyti teisės aktų pakeitimus. Turėtų būti taikomos tinkamos apsaugos priemonės, kaip nustatyta teisės aktuose.
GKV PP naudojamų požymių NVI Vėžio registro informacinėje sistemoje sąrašas pateiktas 2.8.5.1 lentelėje.
2.8.6. Mirties priežasčių registro informacinė sistema
GKV PP naudojamų požymių Mirties priežasčių registro informacinėje sistemoje sąrašas pateiktas 2.8.6.1 lentelėje
2.8.7. Vakcinacijos nuo GKV registravimo informacinė sistema
GKV PP naudojamų požymių Vakcinacijos nuo GKV informacinėje sistemoje (ESPBI IS/GKV PP posistemė) sąrašas pateiktas 2.8.7.1 lentelėje.
2.8.7.1 lentelė. Naudojami požymiai Vakcinacijos nuo GKV informacinėje sistemoje (ESPBI IS/GKV PP posistemė)
| Požymiai |
| Lytis |
| Amžius |
| Asmens kodas |
| Vardas |
| Pavardė |
| Gyvenamoji vieta |
| Asmens sveikatos priežiūros įstaiga |
| Gydančio gydytojo pavardė ir unikalus numeris |
| Siuntimo atlikti vakcinacijos data |
| Vakcinos tipas |
| Vakcinacijos data: pirmutinės ir paskutinės |
| Nepageidaujamos reakcijos |
| Vakcinaciją atlikusio specialisto pavardė ir unikalus numeris |
| Diagnozė pagal TLK-10 |
| Susirgimo GKV data |
| Mirties nuo GKV data |
2.9. GKV PP gautų duomenų saugojimo ir archyvavimo principai
GKV PP gautų duomenų saugojimo ir archyvavimo principai:
· Asmens sveikatos priežiūros įstaigos užtikrina tinkamą gautų duomenų saugojimą ir archyvavimą (formų, ėminių, mėginių, atliekų, ataskaitų).
· Visi gauti įrašai saugiai laikomi taip, kad prireikus būtų galima greitai juos rasti.
· Gauti duomenys saugomi ne mažiau kaip 20 metų.
2.10. Daugiadalykis konsiliumas
Daugiadalykis konsiliumas (DDK) – tai programoje dalyvaujančių įvairių sričių gydytojų pasitarimas. Šių pasitarimų tikslas – aptarti tolesnę pacienčių priežiūrą, ištyrimą ir gydymą tais atvejais, kai nesutampa citologinių, histologinių ir kolposkopinių tyrimų rezultatai, taip pat atlikti retrospektyvinę netipinių atvejų analizę.
DDK organizuoja programą koordinuojantis centras. Šie pasitarimai organizuojami keturis kartus per metus, prireikus – dažniau. DDK dalyvauja gydytojai akušeriai-ginekologai, gydytojai patologai, laboratorinės medicinos gydytojai, konsultuojantys ar atliekantys tyrimus GKV PP. Privalomai dalyvauja pacientę, kurios klinikinė situacija aptariama konsiliume, gydantis gydytojas.
Rekomenduojama DDK aptarti visus šiuos atvejus:
· kai kolposkopuojant įtariami aukšto laipsnio pakitimai, tačiau citologinis ir histologinis tyrimai jų nepatvirtina;
· kai yra ribinių pakitimų endocervinėse ląstelėse, taip pat nustatomas aukštos rizikos ŽPV, tačiau kolposkopija ir histologiniu tyrimu pokyčių neaptinkama;
· visais atvejais, kuomet klinikinį atvejį nori aptarti kolposkopuotojas, histologas ar citologas.
Prieš DDK specialistai peržiūri turimus duomenis, DDK metu esant reikalui turi būti galimybė demonstruoti citologinių tepinėlių, kolposkopinius, histologinių tyrimų vaizdus.
Aptarus klinikinę situaciją ir peržiūrėjus tyrimų duomenis nusprendžiama tolesnė ištyrimo ir gydymo taktika. Specialistų išvados dokumentuojamos pacientės medicininiuose dokumentuose, išvada įkeliama į GKV PP sistemą.
II SKYRIAUS PRIEDAI
1 priedas. Kvietimas atlikti citologinį tyrimą (priminimas, pakartotinis kvietimas)
2 priedas. Kvietimas atlikti ŽPV tyrimą (priminimas, pakartotinis kvietimas)
3 priedas. Informacinis pranešimas apie citologinį tyrimą
4 priedas. Informacinis pranešimas apie ŽPV tyrimą
5 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai moteris kviečiama atvykti kartoti tyrimą po 3 mėn. (įprastinis citologinis tyrimas)
6 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai nenustatyta pokyčių (kitas kvietimas – po 3 metų) (įprastinis citologinis tyrimas)
7 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai reikalinga gydytojo akušerio ginekologo konsultacija su kolposkopija (įprastinis citologinis tyrimas)
8 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai moteris kviečiama atvykti kartoti tyrimą ne anksčiau kaip po 3 mėn. (ŽPV tyrimas)
9 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai ŽPV nenustatytas (kitas kvietimas – po 5 metų) (ŽPV tyrimas)
10 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai buvo atliktas papildomas citologinis PAP tyrimas ir moteris kviečiama atvykti kartoti tyrimą po 3 mėn. (ŽPV tyrimas)
11 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai buvo atliktas papildomas citologinis PAP tyrimas ir reikalinga gydytojo akušerio ginekologo konsultacija po vienerių metų (ŽPV tyrimas)
12 priedas. Informacinis pranešimas apie tyrimų rezultatus, kai buvo atliktas papildomas citologinis PAP tyrimas ir reikalinga gydytojo akušerio ginekologo konsultacija su kolposkopija (ŽPV tyrimas)
13 priedas. Pacientės sutikimas dalyvauti gimdos kaklelio vėžio profilaktinės patikros programoje
1 priedas
KOORDINACINIO CENTRO PAVADINIMAS
Gimdos kaklelio vėžio profilaktinės patikros programa
2021-01-14
Vardas Pavardė
Miestas, Gatvė g. 4-1
Gerb. [kviečiamos moters vardas ir pavardė],
Jūs kviečiama atvykti atlikti gimdos kaklelio tyrimą, kurio pagalba gali būti nustatyti gimdos kaklelio pakitimai kurie, jei nebus gydomi, didina riziką susirgti gimdos kaklelio vėžiu. Rūpindamiesi Jūsų sveikata, užregistravome Jus į nemokamą profilaktinį tyrimą.
|
2021 m. kovo 2 d. 17.00 val. esate kviečiama profilaktiškai pasitikrinti dėl gimdos kaklelio ligų
|
Vieta:
Klinikos pavadinimas 5 kab. (Gatvė g. 4, Miestas) |
|
| Turėti asmens tapatybę patvirtinantį dokumentą |
|
Jei negalite atvykti nurodytu laiku, prašom paskambinti tel. [telefono nr.] [nurodomos darbo valandos ir laikas] ir susitarti dėl Jums tinkamo laiko.
Tepinėlis imamas ne menstruacijų metu. Likus parai (24 val.) iki tyrimo turėtumėte nenaudoti tamponų, intravaginalinių preparatų, taip pat reikėtų vengti lytinių santykių, neplauti makšties.
Apie tyrimo rezultatą būsite informuota laišku ir informacija apie tyrimo rezultatus bus patalpinta e. sveikatos sistemoje, praėjus 3–4 savaitėms po tyrimo medžiagos paėmimo. Yra tikimybė, kad tyrimą reikės pakartoti – dėl įvairių priežasčių jis gali būti neinformatyvus. Todėl jei būsite pakviesta atvykti dar kartą, tai yra visiškai normalu.
Prašome Jūsų susisiekti su mumis telefonu [telefono nr.] ir pranešti, jeigu negalite (tikrinotės dėl gimdos kaklelio ligų per pastaruosius 12 mėn. kitur, laukiatės ar neseniai gimdėte, Jums atlikta visiška arba radikali histerektomija) ar nenorite dalyvauti programoje. Taip pat šiuo telefono numeriu kreipkitės, jei negavote informacijos praėjus 4 ar daugiau savaičių nuo tyrimo atlikimo. Kitais klausimais prašome konsultuotis su savo šeimos gydytoju. Mes rūpinamės Jūsų sveikata.
Pagarbiai
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
2 priedas
KOORDINACINIO CENTRO PAVADINIMAS
Gimdos kaklelio vėžio profilaktinės patikros programa
2021-01-14
Vardas Pavardė
Miestas, Gatvė g. 4-1
Gerb. [kviečiamos moters vardas ir pavardė],
Jūs kviečiama atvykti atlikti profilaktinį žmogaus papilomos viruso (ŽPV) tyrimą, kurio pagalba gali būti nustatytas ŽPV, galintis sukelti gimdos kaklelio ląstelių pokyčius. Rūpindamiesi Jūsų sveikata, užregistravome Jus į nemokamą profilaktinį tyrimą.
|
2021 m. kovo 2 d. 17.00 val. esate kviečiama profilaktiškai pasitikrinti dėl gimdos kaklelio ligų
|
Vieta:
Klinikos pavadinimas 5 kab. (Gatvė g. 4, Miestas) |
|
| Turėti asmens tapatybę patvirtinantį dokumentą |
|
Jei negalite atvykti nurodytu laiku, prašom paskambinti tel. [telefono nr.] [nurodomos darbo valandos ir laikas] ir susitarti dėl Jums tinkamo laiko.
Tepinėlis imamas ne menstruacijų metu. Likus parai (24 val.) iki tyrimo turėtumėte nenaudoti tamponų, intravaginalinių preparatų, taip pat reikėtų vengti lytinių santykių, neplauti makšties.
Apie tyrimo rezultatą būsite informuota laišku ir informacija apie tyrimo rezultatus bus patalpinta e. sveikatos sistemoje, praėjus 3–4 savaitėms po tyrimo medžiagos paėmimo. Yra tikimybė, kad tyrimą reikės pakartoti – dėl įvairių priežasčių jis gali būti neinformatyvus. Todėl jei būsite pakviesta atvykti dar kartą, tai yra visiškai normalu.
Prašome Jūsų susisiekti su mumis telefonu [telefono nr.] ir pranešti, jeigu negalite (tikrinotės dėl gimdos kaklelio ligų per pastaruosius 12 mėn. kitur, laukiatės ar neseniai gimdėte, Jums atlikta visiška arba radikali histerektomija) ar nenorite dalyvauti programoje. Taip pat šiuo telefono numeriu kreipkitės, jei negavote informacijos praėjus 4 ar daugiau savaičių nuo tyrimo atlikimo. Kitais klausimais prašome konsultuotis su savo šeimos gydytoju. Mes rūpinamės Jūsų sveikata.
Pagarbiai
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
- Kodėl reikia pasitikrinti dėl gimdos kaklelio vėžio?
Kiekvienais metais Lietuvoje gimdos kaklelio vėžys diagnozuojamas apie 500 moterų. Ligą diagnozavus anksti, galima išgydyti iki 98 proc. moterų, tačiau jei liga diagnozuojama jau išplitusi, pasveikimo galimybės mažėja, todėl kiekvienais metais nuo šios ligos miršta apie 200 moterų. Gimdos kaklelio vėžys dažniausiai diagnozuojamas jaunoms, vaisingo amžiaus moterims. Po krūties vėžio tai yra antra pagal dažnumą 25–34 metų moterų onkologinė liga. Reguliariai tikrinantis, gimdos kaklelio vėžio galima išvengti. Lietuvoje yra vykdoma valstybinė gimdos kaklelio piktybinių navikų profilaktinės patikros programa: privalomuoju sveikatos draudimu apdraustos 25–34 metų amžiaus moterys gali vieną kartą per trejus metus nemokamai pasitikrinti gimdos kaklelio sveikatos būklę ir atlikti gimdos kaklelio citologinį tyrimą (PAP testą).
![]()
- Kas sukelia gimdos kaklelio vėžį?
Gimdos kaklelio vėžys vystosi iš pakitusių gimdos kaklelio gleivinės ląstelių. Tokius pokyčius sukelia aukštos rizikos žmogaus papilomos virusas (arba ŽPV). Žmogaus papilomos virusu per gyvenimą užsikrečia net 80 proc. žmonių. Vis dėlto užsikrėtimas šia infekcija dar nereiškia vėžio diagnozės. Vėžys vystosi, jei organizmas su šia infekcija negeba kovoti ir infekcija išlieka ilgai. Yra žinoma, kad 9 iš 10 ŽPV užsikrėtusių moterų virusas pasišalina iš organizmo per 2 metus, apie 10 proc. atvejų kai kurie ŽPV tipai išlieka ir sukelia ląstelių pokyčius. Pradžioje ląstelės pakinta ir tampa nenormalios, tačiau jos dar nėra vėžinės. Nediagnozuoti ir negydomi šie pokyčiai progresuoja į gimdos kaklelio vėžį. Tai gali užtrukti nuo vienų iki 10 metų ir ilgiau. Rizika, kad infekcija išliks ir vystysis vėžys, yra didesnė, jei:
· moteris užsikrečia didelės onkogeninės rizikos ŽPV;
· anksti pradedamas lytinis gyvenimas;
· dažnai keičiami lytiniai partneriai;
· moteris serga kita lytiškai plintančia infekcija;
· yra nusilpusi imuninė sistema (po organų transplantacijos, chemoterapijos, dėl ŽIV);
· moteris rūko;
· moters mityba yra nepakankama (ypač jei trūksta vaisių ir daržovių);
· moteris yra nutukusi;
· ŽPV užsikrėtusi moteris ilgai vartoja sudėtines kontraceptines tabletes;
· moteris yra gimdžiusi daugiau kaip tris kartus arba pirmą kartą gimdė jaunesnė nei 17 metų.
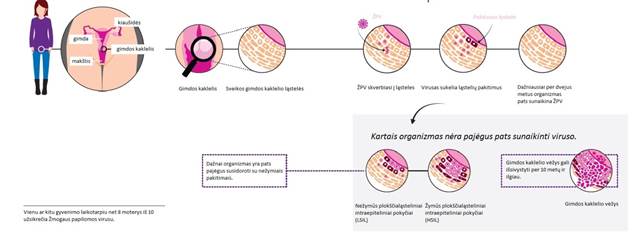
- Ką svarbu žinoti prieš atliekant tyrimą?
Prieš atliekant PAP testą moteris turi būti nusišlapinusi (pilna šlapimo pūslė ar žarnynas tyrimo metu gali sukelti nepatogumo jausmą). Tyrimas neatliekamas mėnesinių metu. 24 val. prieš tyrimą nepatartina naudoti tamponų, intravaginalinių preparatų, lytiškai santykiauti ar plauti makšties.
- Kaip atliekamas tyrimas?
PAP testas atliekamas ginekologinės apžiūros kabinete, moteriai gulint ginekologinėje kėdėje. Į makštį atsargiai įkišamas specialus skėtiklis, apžiūrimas gimdos kaklelis. Specialiu steriliu švelniu šepetėliu paimamas ląstelių mėginys nuo gimdos kaklelio paviršiaus ir iš kanalo. Ėminys užtepamas ant stiklelio ir išsiunčiamas į laboratoriją. Procedūra – greita ir neskausminga, o su pasiruošimu užtruks apie 15 minučių.


- Ką parodo tyrimo rezultatai?
Mėginys tiriamas laboratorijoje. Kartais tiriamoji medžiaga yra netinkama tirti. Taip gali atsitikti dėl daugelio priežasčių, tad retsykiais tyrimą reikia pakartoti. Per 3–4 savaites gausite laišką su tyrimo rezultatais ir informacija ką reikia daryti toliau. Galimi rezultatų variantai yra tokie:
- Kokie tyrimo pranašumai ir trūkumai?
Jau 80 metų visame pasaulyje PAP testas yra naudojamas kaip veiksminga gimdos kaklelio ligų ir vėžio diagnostikos priemonė. Vis dėlto dėl tyrimo specifikos ir esant tam tikroms organizmo būklėms sveikos ląstelės gali būti įvertintos kaip pakitusios arba tyrimo rezultatas gali būti įvertintas kaip normalus, nors gimdos kaklelyje pakitusių ląstelių bus.
- Kur galima gauti papildomos informacijos?
Papildomos informacijos apie gimdos kaklelio vėžio profilaktinės patikros programos vykdymą galite rasti Valstybinės ligonių kasos interneto svetainėje (vlk.lt → Veikla → Veiklos sritys → Prevencinės programos → Apie prevencines programas → Gimdos kaklelio vėžio ankstyvosios diagnostikos programa). Gimdos kaklelio vėžio profilaktinės patikros programa vykdoma vadovaujantis LR sveikatos apsaugos ministro įsakymais. Jei ieškote papildomos informacijos, susijusios su šio laiško turiniu, galite kreiptis į Koordinavimo centrą tel. 8 630 00 000 arba el. paštu [email protected]
|
Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašom informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Koordinavimo centre Lietuvos Respublikos teisės aktų nustatyta tvarka ir neperduodami trečiosioms šalims. |
![]()
INFORMACINĖ MEDŽIAGA APIE GIMDOS KAKLELIO VĖŽIO PROFILAKTINĖS PATIKROS PROGRAMĄ
- Kodėl reikia pasitikrinti dėl gimdos kaklelio vėžio?
Kiekvienais metais Lietuvoje gimdos kaklelio vėžys diagnozuojamas apie 500 moterų. Ligą diagnozavus anksti, galima išgydyti iki 98 proc. moterų, tačiau jei liga diagnozuojama jau išplitusi, pasveikimo galimybės mažėja, todėl kiekvienais metais nuo šios ligos miršta apie 200 moterų. Gimdos kaklelio vėžys dažniausiai diagnozuojamas 25–59 metų amžiaus moterims. Po krūties vėžio tai yra antra pagal dažnumą moterų onkologinė liga. Reguliariai tikrinantis, gimdos kaklelio vėžio galima išvengti. Lietuvoje yra vykdoma valstybinė gimdos kaklelio piktybinių navikų profilaktinės patikros programa: privalomuoju sveikatos draudimu apdraustos 35–59 metų amžiaus moterys gali vieną kartą per penkerius metus nemokamai pasitikrinti gimdos kaklelio sveikatos būklę – atlikti žmogaus papilomos viruso (ŽPV) tyrimą ir, jei reikia, gimdos kaklelio citologinį tyrimą (PAP testą).
- Kas sukelia gimdos kaklelio vėžį?
Gimdos kaklelio vėžys išsivysto iš pakitusių gimdos kaklelio gleivinės ląstelių. Tokius pokyčius sukelia aukštos rizikos žmogaus papilomos virusas (ŽPV). Žmogaus papilomos virusu per gyvenimą užsikrečia net 80 proc. žmonių. Vis dėlto užsikrėtimas šia infekcija dar nereiškia vėžio diagnozės. Vėžys vystosi, jei organizmas su šia infekcija negeba kovoti ir infekcija išlieka ilgai. Yra žinoma, kad 9 iš 10 ŽPV užsikrėtusių moterų virusas pasišalina iš organizmo per 2 metus, apie 10 proc. atvejų kai kurie ŽPV tipai išlieka ir sukelia ląstelių pokyčius. Pradžioje ląstelės pakinta ir tampa nenormalios, tačiau jos dar nėra vėžinės. Nediagnozuoti ir negydomi šie pokyčiai progresuoja į gimdos kaklelio vėžį. Tai gali užtrukti nuo vienų iki 10 metų ir ilgiau. Rizika, kad infekcija išliks ir vystysis vėžys, yra didesnė, jei:
· moteris užsikrečia didelės onkogeninės rizikos ŽPV;
· anksti pradedamas lytinis gyvenimas;
· dažnai keičiami lytiniai partneriai;
· moteris serga kita lytiškai plintančia infekcija;
· yra nusilpusi imuninė sistema (po organų transplantacijos, chemoterapijos, dėl ŽIV);
· moteris rūko;
· moters mityba yra nepakankama (ypač jei trūksta vaisių ir daržovių);
· moteris yra nutukusi;
· ŽPV užsikrėtusi moteris ilgai vartoja sudėtines kontraceptines tabletes;
· moteris yra gimdžiusi daugiau kaip tris kartus arba pirmą kartą gimdė jaunesnė kaip 17 metų.
![]()
- Ką svarbu žinoti prieš atliekant tyrimą?
Prieš atliekant ŽPV testą moteris turi būti nusišlapinusi (pilna šlapimo pūslė ar žarnynas tyrimo metu gali sukelti nepatogumo jausmą). Tyrimas neatliekamas mėnesinių metu. Patartina 24 val. prieš tyrimą nenaudoti tamponų, intravaginalinių preparatų, lytiškai nesantykiauti ir neplauti makšties.
- Kaip atliekamas ŽPV tyrimas?
ŽPV tyrimas atliekamas ginekologinės apžiūros kabinete, moteriai gulint ginekologinėje kėdėje. Į makštį atsargiai įkišamas specialus skėtiklis, apžiūrimas gimdos kaklelis. Specialia švelnia šluotele paimamas ląstelių ėminys nuo gimdos kaklelio paviršiaus ir iš kanalo. Šluotelė dedama į specialų buteliuką ir siunčiama į laboratoriją. Procedūra – greita ir neskausminga, o su pasiruošimu užtruks apie 15 minučių.


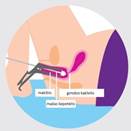
- Ką parodo tyrimo rezultatai?
Mėginys tiriamas laboratorijoje: nustatoma ar mėginyje yra ŽPV, ar ne. Kartais tiriamoji medžiaga yra netinkama tirti. Taip gali atsitikti dėl daugelio priežasčių, tad retsykiais tyrimą reikia pakartoti. Tyrimo rezultatai apytikriai per 3–4 savaites pateks pas Jūsų šeimos gydytoją. Jis, įvertinęs tyrimo rezultatus, Jus informuos, ką reikia daryti toliau. Galimi
rezultatų variantai yra tokie:
- Kokie yra tyrimo pranašumai ir trūkumai?
ŽPV tyrimas pripažintas veiksmingiausia ikivėžinių gimdos kaklelio ligų patikros priemone. Laiku paskirtas gydymas gali užkirsti kelią gimdos kaklelio vėžio vystymuisi. Tai – esminis tyrimo pranašumas. Nepaisant to, šis tyrimas, kaip ir visi kiti tyrimo metodai, turi trūkumų, susijusių su tyrimo atlikimo specifika. Netikslumai yra neišvengiami ir niekaip nepriklauso nuo tyrimą atliekančių žmonių kompetencijos, jų pasitaiko visame pasaulyje visų lygių gydymo įstaigose.
- Kur galima gauti papildomos informacijos?
Papildomos informacijos apie gimdos kaklelio vėžio profilaktinės patikros programos vykdymą galite rasti Valstybinės ligonių kasos interneto svetainėje (vlk.lt → Veikla → Veiklos sritys → Prevencinės programos → Apie prevencines programas → Gimdos kaklelio vėžio ankstyvosios diagnostikos programa). Gimdos kaklelio vėžio profilaktinės patikros programa vykdoma vadovaujantis LR sveikatos apsaugos ministro įsakymais. Jei ieškote papildomos informacijos, susijusios su šio laiško turiniu, galite kreiptis į Koordinavimo centrą tel. 8 630 00000 arba el. paštu [email protected]
|
Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašom informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Koordinavimo centre Lietuvos Respublikos teisės aktuose nustatyta tvarka ir neperduodami trečiosioms šalims. |
![]()
______________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas gimdos kaklelio citologinis tyrimas, kitaip vadinamas PAP testu. Informuojame, kad gavome Jūsų PAP testo rezultatą. Ne anksčiau kaip po 3 mėn. tyrimą reikės pakartoti, todėl numatytu laiku atsiųsime Jums laišką su kvietimu atlikti reikalingą tyrimą.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo, šio laiško turinio ar apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas gimdos kaklelio citologinis tyrimas, kitaip vadinamas PAP testu. Informuojame, kad gavome Jūsų citologinio tyrimo rezultatą. Įvertinus jį, nustatyta, kad pokyčių nėra, todėl papildomų priemonių imtis nereikia. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją [asmens sveikatos priežiūros įstaigos adresas] tel. 8 660 00 000.
Vadovaujantis gimdos kaklelio vėžio profilaktinės patikros programos nuostatomis ir siekiant sumažinti Lietuvos moterų sergamumą gimdos kaklelio vėžiu, po 3 metų Jūs vėl būsite pakviesta atlikti gimdos kaklelio citologinio tyrimo.
![]()
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas gimdos kaklelio citologinis tyrimas, kitaip vadinamas PAP testu. Informuojame, kad gavome Jūsų citologinio tyrimo rezultatą. Įvertinus jį nustatyta, kad Jums reikalingas išsamesnis ištyrimas, todėl rekomenduojame Jums registruotis gydytojo akušerio ginekologo konsultacijai su kolposkopija.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
Gali būti, kad Jus apie PAP testo rezultatą iškart, kai jis buvo įvertintas, telefonu informavo_____________________________________ slaugytoja(s). Jei su Jumis buvo susisiekta iki laiško
asmens sveikatos priežiūros įstaigos pavadinimas
gavimo, laišką ignoruokite.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas tyrimas dėl ŽPV (žmogaus papilomos viruso). Informuojame, kad gavome Jūsų ŽPV tyrimo rezultatą. Ne anksčiau nei po 3 mėn. tyrimą reikės pakartoti, todėl numatytu laiku atsiųsime Jums laišką su kvietimu atlikti reikalingą tyrimą.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
![]()
Gali būti, kad Jus apie ŽPV tyrimo rezultatą iškart, kai jis buvo įvertintas, telefonu informavo ____________________________________ slaugytoja(s). Jei taip, ignoruokite šį laišką.
asmens sveikatos priežiūros įstaigos pavadinimas
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]() ______________________________________________________
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas tyrimas dėl ŽPV (žmogaus papilomos viruso). Informuojame, kad gavome Jūsų ŽPV tyrimo rezultatą. Įvertinus jį, ŽPV neaptikta, todėl papildomų priemonių imtis nereikia. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją [asmens sveikatos priežiūros įstaigos adresas] tel. 8 660 00 000.
Vadovaujantis gimdos kaklelio vėžio profilaktinės patikros programos nuostatomis ir siekiant sumažinti Lietuvos moterų sergamumą gimdos kaklelio vėžiu, po penkerių metų Jūs vėl būsite pakviesta atlikti ŽPV tyrimo.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas tyrimas dėl ŽPV (žmogaus papilomos viruso). Informuojame, kad gavus Jūsų ŽPV tyrimo rezultatus, iš to paties mėginio buvo atliktas papildomas citologinis PAP tyrimas. Įvertinus jį nustatyta, kad tyrimą reikia pakartoti ne anksčiau kaip po 3 mėn., todėl numatytu laiku atsiųsime Jums laišką su kvietimu atlikti reikalingą tyrimą.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
![]()
Gali būti, kad Jus apie ŽPV tyrimo rezultatą iškart, kai jis buvo įvertintas, telefonu informavo_____________________________________ slaugytoja(s). Jei su Jumis buvo susisiekta
asmens sveikatos priežiūros įstaigos pavadinimas
iki laiško gavimo, laišką ignoruokite.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas tyrimas dėl ŽPV (žmogaus papilomos viruso). Informuojame, kad gavus Jūsų ŽPV tyrimo rezultatus, iš to paties mėginio buvo atliktas papildomas citologinis PAP tyrimas. Įvertinus jį nustatyta, kad pokyčių nėra, todėl papildomų priemonių šiuo metu imtis nereikia. Rekomenduojame Jums registruotis gydytojo akušerio ginekologo konsultacijai po vienerių metų.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
![]()
Gali būti, kad Jus apie ŽPV tyrimo rezultatą iškart, kai jis buvo įvertintas, telefonu informavo_____________________________________ slaugytoja(s). Jei su Jumis buvo susisiekta
asmens sveikatos priežiūros įstaigos pavadinimas
iki laiško gavimo, laišką ignoruokite.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
![]()
______________________________________________________
GKV PP KC pavadinimas
Gimdos kaklelio vėžio profilaktinės
patikros programa
Data
Vardas Pavardė
Gerb. ______________________________ paciente,
asmens sveikatos priežiūros įstaigos pavadinimas
primename, kad Jums buvo atliktas tyrimas dėl ŽPV (žmogaus papilomos viruso). Informuojame, kad gavus Jūsų ŽPV tyrimo rezultatus, iš to paties mėginio buvo atliktas papildomas citologinis PAP tyrimas. Įvertinus jį nustatyta, kad Jums reikalingas išsamesnis ištyrimas, todėl rekomenduojame Jums registruotis gydytojo akušerio ginekologo konsultacijai su kolposkopija.
Telefonas pasiteirauti: 8 660 00 000. Jei norėsite išsamiau aptarti tyrimo rezultatus, tai padaryti galite užsiregistravusi pas savo šeimos gydytoją.
![]()
Gali būti, kad Jus apie ŽPV tyrimo rezultatą iškart, kai jis buvo įvertintas, telefonu informavo_____________________________________ slaugytoja(s). Jei su Jumis buvo susisiekta
asmens sveikatos priežiūros įstaigos pavadinimas
iki laiško gavimo, laišką ignoruokite.
Jei turite pastabų dėl gimdos kaklelio vėžio profilaktinės patikros programos vykdymo ar šio laiško turinio arba apie savo tyrimo rezultatą nenorite būti informuojama elektroniniu paštu, susisiekite su Koordinavimo centru tel. 8 660 00 000 arba el. paštu [email protected]
Pagarbiai,
Koordinavimo centras
| Informacija šiame pranešime skirta tik asmeniui, kuriam yra adresuota. Jei šį pranešimą gavote per klaidą, negalite kopijuoti ar kitaip platinti pranešimo ar jo dalies ir skleisti jame esančios informacijos. Prašome informuoti apie tai siuntėją ir sunaikinti visas šio pranešimo kopijas. Dėkojame. |
Duomenys kaupiami ir saugomi Lietuvos Respublikos teisės aktuose nustatyta tvarka |
______________________________________________________
![]() ______________________________________________________
______________________________________________________
Asmens sveikatos priežiūros įstaigos ir įstaigos padalinio, kuriame atliekama procedūra, pavadinimas, kodas, adresas, telefonas (toliau – ASPĮ)
Pacientės (VARDAS PAVARDĖ, AMŽIUS)
sutikimas dalyvauti gimdos kaklelio vėžio profilaktinės patikros programoje
Gimdos kaklelio vėžio profilaktinės patikros programos (tolau – Patikros programa) tikslas yra pakviesti moteris išsitirti siekiant kuo anksčiau diagnozuoti gimdos kaklelio ląstelių pokyčius ir pradėti gydyti, kad sumažėtų moterų sergamumas ir mirtingumas nuo gimdos kaklelio vėžio Lietuvoje.
Per profilaktinę patikrą ginekologinės apžiūros kabinete į makštį įkišamas specialus skėtiklis, leidžiantis pasiekti gimdos kaklelį. Nuo gimdos kaklelio paviršiaus ir iš kanalo sterilia mentele ar šepetėliu paimamas ląstelių mėginys. Tuomet mėginys išsiunčiamas į laboratoriją atlikti citologinio tyrimo.
Procedūra neskausminga, todėl anestezija netaikoma. Procedūros trukmė su pasirengimu – apie 15 minučių.
Šiuo sutikimu patvirtinate, kad:
esate žodžiu ir raštu informuota apie gimdos kaklelio citologinio tyrimo ypatumus ir sutinkate dalyvauti Patikros programoje ir atlikti profilaktinę patikrą;
Jums užteko laiko suprasti pateiktą informaciją, paklausti apie ją gydytojo ir gauti atsakymus;
esate informuota ir sutinkate, kad ASPĮ saugos ir tvarkys Jūsų asmens duomenis sveikatos priežiūros paslaugų teikimo ir Patikros programos vykdymo tikslais ir perduos duomenis apie gimdos kaklelio profilaktinės patikros rezultatus Patikros programos koordinavimo centrui, o šis:
· informuos Jus apie Jūsų tyrimo rezultatus;
· pakvies Jus pakartotinai išsitirti ir konsultuotis dėl tolesnės sveikatos priežiūros;
· kaups ir analizuos duomenis, kad būtų galima užtikrinti kokybišką Patikros programos vykdymą ir tolesnę Jūsų sveikatos būklės stebėseną.
Pacientė arba jai atstovaujantis asmuo [nurodyti atstovavimo pagrindą] _____________
Vardas Pavardė ____________________________________ Parašas ___________________
Sutikimo formos užpildymo data ir laikas _________________________________________
ASPĮ darbuotojas, užpildęs sutikimo formą
Vardas Pavardė ____________________________________ Parašas ___________________
Sutikimo formos užpildymo data ir laikas _________________________________________
III SKYRIUS. PROGRAMOS ĮGYVENDINIMAS PIRMINĖs ASMENS SVEIKATOS PRIEŽIŪROS GRANDYJE
3. PASPC taikomi kokybės užtikrinimo reikalavimai ir rodikliai
3.1. Organizaciniai reikalavimai
Vienas iš svarbiausių vaidmenų įgyvendinant gimdos kaklelio vėžio patikros programą tenka PASPC, todėl itin svarbu, kad juose būtų tinkamai skleidžiama informacija.
PASPC turi būti informacinių lankstinukų apie gimdos kaklelio vėžio patikros programą, jie turėtų būti prieinami besilankančioms moterims.
PASPC privalo užtikrinti programoje dalyvaujančių moterų konfidencialumą pagal Lietuvos Respublikoje galiojančius teisės aktus. Moteriai pageidaujant, turi būti sudarytos galimybės tyrimo metu dalyvauti ją lydinčiam asmeniui.
PASPC turi užtikrinti visų patikros programos reikalavimų įgyvendinimą, taip pat laikytis infekcijų kontrolės procedūrų.
Paimti ėminiai į laboratoriją turi būti išsiunčiami per 5 darbo dienas. Ėminių laikymo reikalavimai nurodyti dalyje „PASPC taikomi kokybės rodikliai ir reikalavimai“.
Visuose PASPC turi būti registruojami visi duomenys, reikalingi atitikčiai kokybės rodikliams ir standartams įvertinti.
PASPC turi vykdyti nuolatinę gimdos kaklelio patikros programos kokybės kontrolę (išsamesnė informacija pateikiama dalyje „PASPC taikomi kokybės rodikliai ir reikalavimai“).
3.2. Personalo kvalifikacijos reikalavimai
Profilaktinius tyrimus gali atlikti tik asmenys, kurie turi galiojančią akušerio, šeimos gydytojo ar gydytojo akušerio-ginekologo licenciją. Visi tepinėlių ėmėjai turi būti baigę intensyvius teorinius ir praktinius 4 val. trukmės gimdos kaklelio patikros kursus.
Kiekvienam PASPC specialistui darbo vietoje turi būti prieinama naujausia informacija apie patikros programą ir mėginių ėmimą, tarp šių informacijos šaltinių turi būti bent GKV PP.
PASPC kartą per metus turi gauti iš Kokybės kontrolės centro ataskaitą apie įstaigoje paimtų ėminių tinkamumą tirti ir paėmimo kokybę. Taip pat turi būti nurodomi ėminius imančio specialisto rodikliai. Jei specialistas 2 m. iš eilės neatitinka ėminio paėmimo kokybės rodiklio, jis turi būti siunčiamas į kvalifikacijos kėlimo kursus. Iki kursų pabaigos specialistas ėminių imti neturėtų.
3.3. Reikalavimai, taikomi įrangai, aplinkai ir priemonėms
Tyrimui atlikti reikalinga įranga:
· ginekologinė kėdė. Ėmimo patalpoje turi būti ginekologinė kėdė. Esant galimybei PASPC skatinami įsigyti reguliuojamo aukščio ginekologines kėdes, kad būtų lengviau įlipti fizinę negalią turinčioms pacientėms;
· reguliuojama lempa.
Tyrimui atlikti reikalingos priemonės:
· vienkartinės pirštinės;
· skėtikliai. Gali būti naudojami vienkartiniai arba daugkartiniai skėtikliai. Vienkartinio skėtiklio pakuotė turi būti atidaroma prieš pat mėginio ėmimą. Turi būti prieinami kelių dydžių skėtikliai. Daugkartiniai skėtikliai turi būti sterilizuojami pagal ES sterilizavimo gaires;
· endocervikalinė šluotelė ar endocervikalinis šepetėlis;
· objektiniai stikleliai, pieštukas ir objektinių stiklelių laikiklis įprastiems tepinėliams;
· fiksatoriai;
· buteliukas ŽPV tyrimo ėminiui imti ir ilgai išliekanti rašymo priemonė.
Visos naudojamos medžiagos turi būti nepasibaigusio galiojimo.
Aplinkai taikomi reikalavimai:
Patikra turi būti atliekama patalpoje, kurioje galima užtikrinti moters konfidencialumą. Patalpos durys turi būti rakinamos arba ginekologinė kėdė ir moters rengimosi vieta atitverta nuo durų širma. Jei patalpoje yra langų, turi būti galimybė juos uždengti žaliuzėmis ar užuolaidomis.
Patalpoje turi būti palaikoma komfortiška kambario temperatūra.
3.4. Tyrimo mėginio ėmimo reikalavimai
Profilaktinio tyrimo mėginys imamas iš patikros programos reikalavimus atitinkančių moterų. Nuo 25 metų amžiaus visoms moterims kas 3 metus imamas gimdos kaklelio tepinėlis citologiniam tyrimui, o nuo 35 metų kas 5 metus – ŽPV tyrimo mėginys. Rekomenduojama išlaikyti intervalus tarp mėginių ėmimo ir tyrimų anksčiau laiko nekartoti.
Ėminys neturėtų būti imamas mėnesinių metu, taip pat esant aiškiai makšties infekcijai ar kraujavimui iš gimdos. 24 val. iki mėginio ėmimo moteris turėtų nenaudoti tamponų, intravaginalinių preparatų, lytiškai nesantykiauti ir neplauti makšties.
Moteriai atvykus į profilaktinį tyrimą, reikia paaiškinti, kokiu tikslu atliekamas tyrimas, aptarti galimus tyrimo rezultatus ir kokio tolesnio ištyrimo gali prireikti. Taip pat būtina pranešti moteriai, kad kartais tyrimą reikia pakartoti po 3–6 mėnesių, jeigu tepinėlio kokybė būtų nepatenkinama. Moteris informuojama, kad apie tyrimų rezultatus jai bus pranešama laišku. Jei tyrimą reikia kartoti, tai atliekama ne trumpesniu kaip 3 mėn. intervalu.
Prieš atliekant tyrimą, būtina gauti rašytinį moters sutikimą (priedas Nr. 1). Moteris gali atsisakyti dalyvauti programoje ir apie šią savo teisę turi būti informuota. Atsisakymą moteris turi patvirtinti raštiškai.
Reikia užduoti moteriai klausimų apie jos bendrą sveikatos būklę, pasiteirauti, ar nėra tokių simptomų kaip kraujavimas ar išskyros, kurie galėtų iškreipti tyrimo rezultatus. Prieš atliekant tyrimą užpildomas tyrimo siuntimo blankas (priedas Nr. 1), kuriame pažymimi identifikaciniai duomenys ir tyrimui svarbi klinikinė informacija – paskutinių mėnesinių data ar gimdymo data arba menopauzės pradžia, kontraceptinių priemonių naudojimas, ankstesnių tyrimų rezultatai ir jų atlikimo data, ligos ar būklės, galinčios turėti įtakos tyrimo rezultato vertinimui (pvz., atrofija, būklė po gimdos kaklelio operacijų ir kt.).
Tyrimui reikalingos priemonės turi būti paruoštos prieš moteriai atsisėdant į ginekologinę kėdę, kad moteris kuo trumpiau būtų nepatogioje padėtyje.
Turi būti užtikrinamas privatumas, šilta ir rami aplinka.
Jei imamas tepinėlis PAP testui, moters identifikaciniai duomenys užrašomi pieštuku ant stiklelio.
Jei imamas ŽPV tyrimo mėginys, identifikacinė informacija užrašoma tušinuku ant buteliuko.
Skėtiklį ėminiui imti reikėtų pasirinkti atsižvelgiant į moters lytinio plyšio plotį, kad būtų galima patogiai įkišti nesukeliant skausmo. Prieš kišant rekomenduojama sušildyti skėtiklį iki kūno temperatūros ranka, ant kurios užmauta pirštinė. Skėtiklis kišamas išilgai angos ašies, į makštį įkišus iki pusės pasukamas 90 laipsnių ir įkišus iki galo atveriamas. Lubrikantai nerekomenduojami.
Jei reikia, galima naudoti truputį drungno vandens ar vandenyje tirpaus lubrikanto, tačiau jis turi neužteršti gimdos kaklelio paviršiaus, nes tai pablogintų mėginio kokybę. Gimdos kaklelis vizualizuojamas. Būtina atkreipti dėmesį į gimdos kaklelio išvaizdą, pokyčius dokumentuoti. Prieš imant mėginį gimdos kaklelį reikia švelniai perbraukti vatos gabalėliu. Prieš imant mėginį neturėtų būti daromi kiti tyrimai ar į makštį pilama skysčių. Kuomet yra akivaizdi makšties infekcija, moteris kraujuoja iš gimdos, tyrimą reikėtų atidėti ir moteriai paskirti kitą vizitą.
3.4.1. Citologinio tyrimo mėginio ėmimas
Tam, kad tepinėlis būtų paimtas kokybiškai, reikia paimti ląstelių iš transformacijos zonos (TZ), t. y. iš epitelių jungties vietos, kur ektocervikso plokščiojo epitelio ląsteles pakeičia endocervikso stulpinio epitelio ląstelės. Ėminį rekomenduojama imti endocervikaline šluotele, taip pat gali būti naudojamas šluotelės ir endocervikalinio šepetėlio derinys.
3.4.1.1. Citologinio tyrimo tepinėlio paėmimas endocervikaline šluotele
Šluotele tuo pačiu metu imamos ir endocervikalinės, ir egzocervikalinės ląstelės. Šluotelės ilgieji šereliai įkišami į gimdos kaklelio kanalą. Šluotelė švelniai spaudžiama prie gimdos kaklelio ir sukama 5 kartus 360 laipsnių kampu pagal laikrodžio rodyklę. Tada šluotele švelniai perbraukiama per objektinį stiklelį, šluotelė apverčiama ir dar kartą perbraukiama per stiklelį. Mėginys ant stiklelio nedelsiant užfiksuojamas – ant stiklelio 3 kartus papurškiama stačiu kampu 20 cm atstumu. Stiklelis horizontaliai paliekamas nudžiūti atviroje erdvėje.
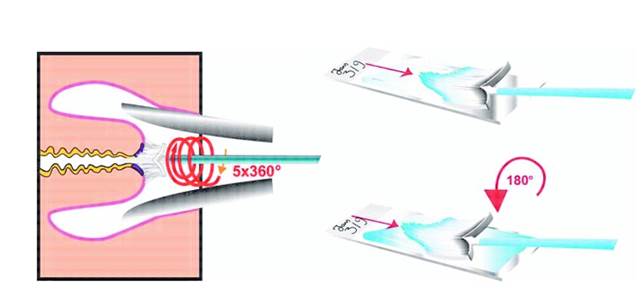
3.4.1.1.1 pav. Citologinio tyrimo tepinėlio ėmimas iš gimdos kaklelio kanalo endocervikaline šluotele ir ląstelių užtepimas ant objektinio stiklelio
3.4.1.2. Citologinio tyrimo tepinėlio paėmimas endocervikaliniu šepetėliu
Endocervikalinio šepetėlio gali prireikti tais atvejais, kai epitelių jungties vieta yra aukštai gimdos kaklelyje (dažnai – po menopauzės), po gimdos kaklelio operacijos ir kt. Patariama naudoti endocervikalinę šluotelę, po to endocervikaliniu šepetėliu atskirai paimti ląstelių iš gimdos kaklelio kanalo. Du trečdaliai endocervikalinio šepetėlio įkišama į endocervikalinį kanalą, kad apatiniai šereliai vis dar būtų matomi, ir švelniai pasukama 90–180 laipsnių kampu. Tuomet šepetėlio galvutė dedama ant objektinio stiklelio ir švelniai, per daug nespaudžiant sukama išilgai stiklelio paviršiaus. Šereliai sukami priešinga kryptimi nei imant mėginį iš gimdos kaklelio kanalo. Tepinėlis nedelsiant užfiksuojamas, kaip aprašyta pirmiau.
3.4.2. ŽPV tyrimo mėginio ėmimas
Mėginys imamas iš gimdos kaklelio taip pat, kaip ir įprastas tepinėlis. Naudojamos tik specialios plastikinės endocervikalinės šluotelės, mėginys imamas pagal gamintojo pateiktus pavyzdžius ir instrukcijas.
Pagal sistemos gamintojo paėmimo rekomendacijas. Rekomenduojama prieš imant tyrimo mėginį susipažinti su turima sistema ir gamintojo instrukcijomis. Tyrimas atliekamas griežtai vadovaujantis gamintojo instrukcija. Atlikus tyrimą buteliuko dangtelis tvirtai užsukamas, kad transportuojant medžiaga nepratekėtų.
Jei imamas citologinis mėginys, svarbu kuo skubiau užfiksuoti medžiagą ant stiklelio, todėl skėtiklis iš makšties išimamas, kai atlikta visa procedūra. Skėtiklis švelniai atpalaiduojamas ir traukiamas iš makšties. Skėtiklis suglaudžiamas tik tuomet, kai gimdos kaklelis nebėra tarp skėtiklio ašmenų.
Po fiksavimo standartinis stiklelis turi visiškai išdžiūti ore horizontalioje padėtyje. Tada jis dedamas į specialią transportavimo dėžutę. Jeigu stiklelis įdedamas per greitai, šlapias mėginys gali prilipti prie kraštų.
Visa tai atlikus būtina išsamiai užpildyti siuntimo formą (Priedas Nr.1) ir ją kartu su ėminiu transportuoti į laboratoriją.
3.5. Tyrimo duomenų registravimas
Pildoma tyrimo siuntimo forma Priedas Nr.1. Joje nurodomi moters identifikaciniai duomenys, siunčiančios įstaigos pavadinimas, mėginio paėmimo data ir laikas, mėginį paėmęs asmuo. Pažymima, koks tyrimo mėginys paimtas. Taip pat nurodoma tyrimui svarbi klinikinė informacija – paskutinių mėnesinių ar gimdymo data arba menopauzės pradžia, kontraceptinių priemonių naudojimas, ankstesnių tyrimų rezultatai ir jų atlikimo data, ligos ar būklės, galinčios turėti įtakos tyrimo rezultato vertinimui (pvz., atrofija, būklė po gimdos kaklelio operacijų ir kt.).
Moters identifikacinius duomenis rekomenduojama pildyti dalyvaujant moteriai, kad būtų išvengta netikslumų. Siuntimo forma turi būti užpildyta aiškiai, įskaitomai.
Ant objektinio stiklelio pieštuku užrašomas įprastoje praktikoje taikomas moterį identifikuojantis žymuo. Ant ŽPV mėginio indelio ta pati informacija užrašoma tušinuku.
Apie mėginio paėmimą pažymima moters medicininiuose dokumentuose (ambulatorinėje kortelėje ar informacinėje sistemoje), nurodoma data, vėliau įrašomas tyrimo rezultatas.
3.6. Komunikacija su moterimi
Moteriai atvykus į profilaktinį tyrimą, reikia paaiškinti, kokiu tikslu atliekamas tyrimas, aptarti galimus tyrimo rezultatus ir kokio tolesnio ištyrimo gali prireikti. Taip pat moteriai būtina pranešti, kad kartais po 3–6 mėnesių tyrimą reikia pakartoti, jeigu tepinėlio kokybė nepatenkinama. Kai tyrimą reikia kartoti, tai turi būti daroma ne trumpesniu kaip 3 mėn. intervalu. Moteris taip pat informuojama, kad tyrimų rezultatas bus pranešamas laišku, o jei prireiks tolesnio ištyrimo, ji bus užregistruota automatiškai.
3.7 PASPC taikomi kokybės rodikliai ir reikalavimai
Moteriai, kuri negali būti laikoma gebančia protingai vertinti savo interesų, arba išreiškia pageidavimą LR Pacientų teisių ir žalos sveikatai atlyginimo įstatyme nustatyta tvarka, turi būti sudarytos galimybės tyrimo metu dalyvauti ją lydinčiam asmeniui. Tepinėlių ėmėjai turėtų stengtis padėti fizinę ar intelekto negalią turinčioms moterims, suteikdami pakankamai laiko ir užtikrindami jų poreikius tenkinančią aplinką. Kur įmanoma, turėtų būti užtikrinamas neįgaliųjų vežimėlių naudojimas.
PASPC turi užtikrinti visų toliau pateiktų reikalavimų įgyvendinimą vykdant patikros programą, taip pat laikytis infekcijų kontrolės procedūrų. Norint užtikrinti efektyvumą, būtina reguliariai stebėti ir peržiūrėti infekcijų kontrolės procedūras. Vienkartiniai skėtikliai ir gimdos kaklelio šluotelės ir šepetėliai turi būti šalinami kaip klinikinės atliekos.
Paimti ėminiai į laboratoriją išsiunčiami per 5 darbo dienas kartu su užpildyta forma (Priedas nr. 2). Citologinio tepinėlio stikleliai išdžiovinami ir dedami į specialią transportavimo dėžutę, kurioje gali būti laikomi iki patekimo į laboratoriją. ŽPV tyrimo mėginių buteliukai laikomi kambario temperatūroje.
Visuose PASPC turi būti registruojami visi duomenys, reikalingi atitikčiai kokybės rodikliams ir standartams įvertinti. Privalu registruoti paimtus tepinėlius, tepinėlį paėmusį asmenį, tepinėlio tinkamumą tyrimui, tepinėlio tyrimo atsakymą, taip pat registruojamas tepinėlio paėmimo laikas, jo išsiuntimo į laboratoriją laikas, rezultato gavimo laikas. Privalu gauti visų paimtų mėginių tyrimų atsakymus. Negavus tyrimo atsakymo per 21 dieną būtina aiškintis negavimo priežastį.
PASPC turėtų periodiškai tikrinti savo veiklą, susijusią su gimdos kaklelio vėžio patikra, ir atitiktį kokybės užtikrinimo gairėms. Kiekvienas PASPC specialistas, atliekantis patikros tyrimus, periodiškai turėtų gauti savo imamų mėginių kokybės rezultatus (rekomenduojama – kas 1 metus). PASPC turėtų periodiškai atlikti auditą, jo apimtį ir rezultatus dokumentuoti.
III Skyriaus priedai
1 priedas. Profilaktinio GKV tyrimo siuntimo ir atsakymo forma.
| Profilaktinio GKV tyrimo siuntimo ir atsakymo forma(sutikimo forma) |
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
| Siunčiančios sveikatos priežiūros įstaigos pavadinimas, duomenys |
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
| Programa |
Diagnostinis |
|||||||||||||||||||||||||||||||
|
tyrimas
|
tyrimas |
tyrimas |
tyrimas |
|||||||||||||||||||||||||||||
|
AR ŽPV PAP Įprastinis tepinėlis |
||||||||||||||||||||||||||||||||
| Asmens kodas |
|
|||||||||||||||||||||||||||||||
| Vardas |
|
|||||||||||||||||||||||||||||||
| Pavardė |
|
|||||||||||||||||||||||||||||||
| Gimimo data: |
|
|||||||||||||||||||||||||||||||
| Adresas |
|
|||||||||||||||||||||||||||||||
Pacientės ambulatorinė sveikatos istorijos Nr.
|
||||||||||||||||||||||||||||||||
| Medžiagos paėmimo data:
|
|
|
|
|
||||||||||||||||||||||||||||
(metai) |
(mėnuo) |
(diena) |
(valanda) |
(min.) |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
| Ankstesni tyrimai |
|
PAP neimtas Anksčiau PAP norma |
||||||||||||||||||||||||||||||
|
|
|
Nustatyti PAP pakitimai, (data, pakitimas)
AR ŽPV netirta Anksčiau AR ŽPV nerasta
AR ŽPV rasta, nustatyti AR ŽPV tipai |
||||||||||||||||||||||||||||||
| Klinikiniai duomenys |
||||||||||||||||||||||||||||||||
|
|
|
Vaisingo amžiaus moteris |
||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
Menopauzė (kiek metų) |
|
|||||||||||||||||||||||||||||
|
|
|
Buvusi gimdos kaklelio d/c, (data, pakitimai) |
|
|||||||||||||||||||||||||||||
|
|
Tyrimą paėmė: |
|
|
|||||||||||||||||||||||||||||
| Data |
|
|
|
|||||||||||||||||||||||||||||
|
|
(metai) |
(mėnuo) (diena) |
|
|||||||||||||||||||||||||||||
| Siunčiančios sveikatos priežiūros įstaigos pavadinimas, duomenys |
|
|||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
| Laboratorijos pavadinimas |
|
|||||||||||||||||||||||||||||||
| Citologinis tyrimas |
|
|||||||||||||||||||||||||||||||
| Tyrimo Nr. |
|
|||||||||||||||||||||||||||||||
|
|
Ėminio gavimo data |
|
||||||||||||||||||||||||||||||
|
|
Mėginys |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
plokščio epitelio kiekis |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
Yra |
|
|
|
||||||||||||||||||||||||||||
|
|
Makroskopinis aprašymas |
|
||||||||||||||||||||||||||||||
| Išvada
|
|
|||||||||||||||||||||||||||||||
| Suteiktos paslaugos kodas |
Morfologinis kodas
|
TLK |
|
|||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
| I vertintojas |
|
|
||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
| II vertintojas |
|
|
||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
| Gydytojas patologas |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
| Atsakymo data |
|
|
|
|||||||||||||||||||||||||||||
| AR ŽPV DNR tyrimas Laboratorijos pavadinimas |
|
|||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
ŽPV 16 |
ŽPV 18 |
ŽPV kiti |
|
|
|||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||
| Tyrimą atliko/patvirtino: |
|
|||||||||||||||||||||||||||||||
| Atsakymo data |
|
|||||||||||||||||||||||||||||||
IV SKYRIUS. CITOLOGINIŲ TYRIMŲ KOKYBĖS UŽTIKRINIMAS
4.1. Laboratorijos organizaciniai citologinių tyrimų kokybės reikalavimai
Įstaigos ar laboratorijos kokybiniai reikalavimai ir standartai turi atitikti LR teisės aktus, nustatančius patologijos tyrimų kokybės reikalavimus.
Standartai yra dokumentais pagrįsti susitarimai, kuriuose pateikiamos techninės specifikacijos ar kiti tikslūs kriterijai, kurie turi būti nuosekliai naudojami kaip taisyklės ar gairės, ir charakteristikų apibrėžtys, siekiant užtikrinti, kad medžiagos, produktai, procesai ir paslaugos atitiktų jų paskirtį.
· Laboratorijos licencija gaunama atliekant laboratorijos išorės auditą.
· Laboratorijos akreditacija yra savanoriška.
· Laboratorija turi turėti LIS, pasižyminčia patikima duomenų apsauga, pacientų duomenų atsekamumu.
· LIS turi būti susieta su ESPBI IS GKV PP posisteme. Rezultatai iš LIS automatiškai perkeliami į ESPBI IS GKV PP posistemę. Mėginių tyrėjai turi turėti prieigą prie ESPBI IS GKV PP posistemės, kad galėtų atlikti rezultatų analizę.
· Laboratorijoje turi dirbti bent vienas gydytojas patologas, ištiriantis ne mažiau 1000 ginekologinės citologijos mėginių per metus.
· Laboratorijos personalas turi dalyvauti mokslinėje veikloje.
· Laboratorijos personalas turi turėti galimybę naudotis naujausiais citologijos vadovėliais, žurnalais ir (arba) naudotis naujausiais informacijos ištekliais.
4.1.1. Reikalavimai, taikomi citologijos laboratorijų patalpoms ir įrangai
Patalpos ir baldai turi atitikti Lietuvos Respublikos higienos normas.
Tinkamos darbo sąlygos atitinka šiuos reikalavimus:
· Laboratorija turi būti įrengta taip, kad visas funkcijas būtų galima tinkamai atlikti laikantis darbo vietos saugos ir higienos standartų:
· visos zonos turi būti gerai apšviestos, laikantis LR patvirtintų higienos normų darbo vietų apšvietimui.
· patalpos turi būti gerai vėdinamos, atitikti temperatūros reikalavimus, laikantis LR patvirtintų higienos normų darbo patalpų šiluminiam komfortui ir pakankamai šiluminei aplinkai. (patalpos turi būti tylios, laikantis LR patvirtintų darbuotojų saugos ir sveikatos reikalavimų, skirtų apsaugai nuo triukšmo keliamos rizikos reglamentuoti.
· Mėginių paruošimo, mikroskopavimo ir sekretoriato patalpos turi būti atskiros.
· Mėginių ruošimo patalpoje turi būti:
c) biologiniai apsaugos gaubtai laikantis LR patvirtintų teisės aktų dėl biologinių medžiagų poveikio darbe matavimo ir vertinimo.
e) tinkamos degiųjų ir nuodingų cheminių medžiagų laikymo spintos, laikantis LR patvirtintų higienos normų cheminių medžiagų profesiniam poveikiui matuoti ir vertinti.
b) pakankamai erdvės darbo vietai, kad būtų galima atlikti mikroskopinį tyrimą, įvesti rezultatus į LIS ir atlikti statistinę analizę, laikantis LR patvirtintų higienos normų saugiam ir sveikatai nekenkiančiam darbui su videoterminalais.
Dažymo įranga, mikroskopai
· Įranga priklauso nuo to, ar dažymas yra automatizuotas, ar rankinis.
· Gimdos kaklelio citologiniams mėginiams dažyti rekomenduojami originalūs arba modifikuoti Papanicolaou dažai. Mėginius nudažius, chromatinas ląstelėse turi būti ryškus, gerai kontrastuoti su citoplazma, o citoplazma turi būti skaidri.
· Vertintojai turi dirbti su aukštos kokybės binokuliniais mikroskopais, reguliariai prižiūrimais medicininės technikos specialisto.
· Citologinei mikroskopijai būtini 4x, 10x, 20x ir 40x objektyvai. Rekomenduojamas žymėjimo objektyvas, kad būtų galima pažymėti rastus pokyčius.
4.1.2. Personalo kokybinės kvalifikacijos
Gimdos kaklelio citologinio tyrimo (PAP testo) mėginiai dažomi ir tiriami laboratorijose, kurios turi patologijos tyrimų veiklos licenciją ir atitinka LR teisės aktus, nustatančius patologijos tyrimų kokybės reikalavimus. Citologijos laboratorijai, skyriui ar padaliniui turi vadovauti gydytojas patologas. Laboratorijoje turi dirbti atitinkamos kvalifikacijos specialistai, kuriems vadovauja medicinos specialistas. Citologijos laboratorija turi atitikti kokybės standartus, išlaikant reikiamą kompetenciją. Kiekvieno darbuotojo pareigos turi būti aprašytos laboratorijos kokybės vadove, pagal kurį vertinamas pareigų vykdymas.
4.1.3. Personalo kvalifikacija ir kompetencija
Gimdos kaklelio mėginius gali vertinti gydytojas patologas, biomedicinos technologas, medicinos biologas.
Gydytojui patologui keliami reikalavimai ir atliekamos užduotys:
· LR galiojanti gydytojo patologo licencija;
· dalyvavimas bendruose gydytojų aptarimuose susipažinimas su laboratorijos vidinės ir išorinės kokybės kontrolės dokumentais;
· pakartotinė patologinių mėginių patikra ir jų rezultatų patvirtinimas;
· mėginių nevertinus ≥ 12 mėn., 150 mėginių pakartotinė peržiūra, diagnozuojant žymius intraepitelinius pokyčius (HSIL) 95 proc. specifiškumu;
· esant nesutapimų tarp morfologinio ir klinikinio vaizdo, mėginių peržiūra ir, jei yra neatitikimų, rezultatų koregavimas;
· atvejų, kurių citologinio ir (arba) histologinio tyrimų rezultatai nekoreliuoja, apžvalga ir aptarimas laboratorijoje;
· bendravimas su ginekologais ir kitais mėginių ėmėjais;
· rekomendacijų dėl (tęstinio) personalo mokymo rengimas ir atnaujinimas;
· dalyvavimas vidinės ir išorinės kokybės kontrolės procesuose.
Moterų, neturinčių specifinių gimdos kaklelio patologijos simptomų ar anamnezėje patvirtintos patologijos, gimdos kaklelio mėginių patikrinimą gali atlikti vertintojas medicinos biologas ir biomedicinos technologas, baigęs 320 val. kvalifikacijos kursų programą ir turintis tai patvirtinantį pažymėjimą. Jie atlieka pirminę ir greitą gimdos kaklelių mėginių peržiūrą, pasirašo neigiamus ir neinformatyvius gimdos kaklelio mėginių rezultatus.
Medicinos biologai ir biomedicinos technologai privalo dalyvauti vidiniuose ir išoriniuose tęstiniuose mokymuose (žr. 4.1.10 dalį).
Siekiant palaikyti vertintojų profesionalumą, rekomenduojama, kad per metus jie įvertintų mažiausiai 1000 mėginių.
Siekiant užtikrinti vertinimo kokybę, maksimalus pirminio mikroskopavimo laikas per dieną yra 5 val., maksimali bendra mikroskopavimo trukmė – 6 val. per dieną (į bendrą mikroskopavimo laiką įtraukiama pirminė ir greitoji peržiūra bei reguliarios pertraukos tarp peržiūrų). Vertindamas vieną mėginį technologas sugaišta vidutiniškai 5 minutes, dokumentuodamas – 1 minutę. Nepertraukiamas vertinimas negali trukti ilgiau kaip 2 valandas. Rekomenduojamos mažiausiai 20 min. pertraukos ir kelių sekundžių pertraukos kas 10–15 minučių. Biomedicinos technologas ir medicinos biologas gali įvertinti ne daugiau kaip 10 mėginių per valandą ir ne daugiau kaip 60 mėginių per dieną per šešias valandas ir pateikti su atvejais susijusius rezultatus.
Jei vertintojas negali atlikti mėginių vertinimo ≥ 6 mėn. arba atlikus metinę statistinę analizę teigiamas prognozinis rodiklis neatitinka 65–85 proc. intervalo, vertintojas turi dalyvauti kvalifikacijos patikrinime ir mokymuose, kuriuos organizuoja Gimdos kaklelio patikros programos koordinavimo centras.
Rekomenduojama, kad per metus nebūtų vertinama daugiau kaip 12 000 mėginių.
Medicinos biologas, turintis ne mažesnę nei 5 metų gimdos kaklelio citologinių mėginių vertinimo patirtį, atsakingas už:
· visų patikros proceso etapų kokybės kontrolę, įskaitant įrangos priežiūrą, dažymą ir mikroskopinę diagnozę;
· pagalbą biomedicinos technologams atliekant analitines procedūras ir tyrimus ir šių specialistų priežiūrą;
· bendravimą su patologu, ypatingų atvejų aptarimą tarp biomedicinos technologo, medicinos biologo ir gydytojo patologo;
· citologinių tyrimų ataskaitų rengimą ir pateikimą regioniniam ar nacionaliniam vėžio patikros registrui (laiku ir pagal galiojančias normas);
· tolesnių rezultatų stebėjimą, su kokybe susijusios veiklos užtikrinimą, mėginių ir rezultatų archyvavimą (kaip aprašyta toliau, žr. 4.1.9 ir 4.1.10 dalis);
· pagalbą mokslininkams toje pačioje programos srityje.
Norint tinkamai nustatyti gimdos kaklelio pokyčius, į biomedicinos technologų ir medicinos biologų darbo procesą įtraukiamos:
· administracinės užduotys: bendravimas su mėginių ėmėjais, šeimos gydytojais, ginekologais, kitomis laboratorijomis ir ligoninėmis;
· laboratorijos techninės užduotys: mėginių tvarkymas, atitinkamų laboratorinių metodų taikymas ir nustatytų sveikatos ir saugos procedūrų vykdymas.
Reikalavimai, taikomi kitiems laboratorijos darbuotojams:
· pareigas atitinkantis išsilavinimas ir patirtis;
· medicininės terminijos išmanymas;
· gebėjimas dirbti su teksto rengimo programomis ir duomenų bazių sistemomis.
Biomedicinos technologai ir medicinos biologai privalo dalyvauti tęstiniuose mokymuose, kuriuos sudaro vidiniai ir išoriniai tęstiniai mokymai.
Vidinius tęstinius mokymus sudaro:
· sunkių arba apžvalginių atvejų aptarimas tarp biomedicinos technologų, medicinos biologų ir patologų (turėtų būti naudojamas daugiagalvis mikroskopas).
Išorinius tęstinius mokymus gali apimti kai kurie arba visi šie elementai (pasirenkami 2–3 elementai):
· dalyvavimas kasmetiniuose darbo rezultatų aptarimuose, seminaruose, simpoziumuose, reguliariuose žinių atnaujinimo kursuose;
· dalyvavimas regioninėse mėginių peržiūrose tarp laboratorijų;
· dalyvavimas kvalifikacijos patikrinimuose – savanoriškas arba, neatitinkant vertinimo kokybės reikalavimų, privalomas (žr. 4.1.10 dalį);
· dalyvavimas vykdant mokslinius tyrimus ir rengiant publikacijas, dalyvavimas atitinkamos medicinos draugijos veikloje.
4.1.4. Mėginių priėmimas ir jų kokybės įvertinimas
Mėginių priėmimas
· Mėginius laboratorija priima su popieriniais ar elektroniniu būdu tinkamai užpildytais siuntimais (forma (žiūrėti III skyriaus priedą Nr.1).
· Mėginiai turi būti tinkamai paženklinti, transportuojami ir pristatomi specialiuose konteineriuose. Jei pildomas elektroninis siuntimas, mėginys siunčiamas kartu su lydraščiais, jei ne – su siuntimo forma (žiūrėti III skyriaus priedą Nr.1).
· Prieš registraciją įvertinama mėginio kokybė. Mėginys laikomas netinkamu, jei:
e) kitos priežastys.
· Jei nustatoma, kad mėginys netinkamas, įvykis registruojamas laboratorijos neatitikčių registre ir susisiekiama su mėginį pateikusia ASPĮ. Nepavykus išspręsti neatitikties problemos, mėginys grąžinamas ASPĮ ir apie tai informuojamas mėginį paėmęs sveikatos priežiūros specialistas. Atvejis registruojamas LIS ir informacija pateikiama į ESPBI IS GKV PP posistemę.
4.1.5. Mėginio registracija ir pranešimas apie patikrą
· Mėginį užregistravus LIS, jam suteikiamas unikalus identifikacijos numeris, rekomenduojama, susietas su brūkšniniu kodu.
· Registruojama mėginio gavimo data, mėginį atsiuntusi ASPĮ ir jį paėmęs sveikatos priežiūros specialistas.
· Siuntimas ir mėginys turi būti paženklinti tuo pačiu identifikaciniu numeriu.
· Laboratorijos informacinėje sistemoje (LIS) įvedami duomenys iš siuntimo formos (žiūrėti III skyriaus priedą Nr.1).
· Pranešimas apie laboratorijoje gautą ir užregistruotą profilaktinės gimdos kaklelio patikros programos mėginį perduodamas į ESPBI IS GKV PP posistemę per 24 val. nuo mėginio gavimo.
4.1.6. Citologinio mėginio ruošimas mikroskopuoti laboratorijoje
· Skystosios terpės mėginiai ruošiami pagal gamintojo instrukcijas.
· Purškiamuoju fiksatoriumi fiksuoti mėginiai prieš dažymo procedūrą mirkomi etanolyje.
· Gimdos kaklelio citologiniai mėginiai dažomi pagal standartinį Papanicolaou protokolą, atliekama kasdienė dažymo kokybės kontrolė.
· Nudažyti mėginiai iškart (negali nudžiūti) dengiami dengiamuoju stikleliu, apimančiu visą medžiagą (paprastai 24 x 50 mm).
· Visos atliekamos laboratorinės procedūros registruojamos LIS ir susiejamos su konkrečiu darbuotoju.
· Prieš atiduodant mėginį patikrai, patikrinamas unikalus indentifikavimo numeris.
4.1.7. Citologinio mėginio mikroskopavimas
Gimdos kaklelio mėginio vertinimas yra kompleksinė procedūra. Atrankos tikslais naudojamas 10x didinimo objektyvas ir 10x didinimo okuliaras. Taip padidinus geriausiai matomas branduolio dydis ir kontrastas, bet struktūrinė skiriamoji geba yra labai prasta net esant gerai fiksacijai. Taigi toks padidinimas gali būti tinkamas orientacijai, bet ginekologiniam tepinėliui vertinti nėra pakankamas. Ląstelių morfologijai nuodugniau vertinti taikomas didesnis, 20x ir 40x objektyvo padidinimas.
Paprastai vertinimas pradedamas viename dengiančiojo stiklelio krašte. Įvertinus vieną regėjimo lauką, staigiu judesiu pereinama į kitą regėjimo lauką. Judesys kartojamas, kol pasiekiamas priešingas dengiančiojo stiklelio kraštas. Tuomet stebėjimas perkeliamas į kitą liniją ir judama link priešingo dengiančiojo stiklelio krašto. Taip peržiūrimas visas stiklelis.
Prieš pradedant mėginio peržiūrą, vertintojui per 24 val. nuo mėginio registravimo datos turi būti suteikta galimybė susipažinti su pacientės patikros istorija, perduota iš nacionalinės informacinės sistemos ar kitų laboratorijų duomenų bazių.
Pirminis mikroskopavimas
· Atliekama visų paruoštų mėginių pirminė patikra.
· Pirminę patikrą atlieka gydytojas patologas, patologijos technologas, medicinos biologas.
· Tiriama visa stiklelio medžiaga naudojant 10x objektyvą, tačiau kai kur, ypač ląstelinguose plotuose, rekomenduojamas lėtesnis žiūrėjimas, vietomis naudojant 20x objektyvą.
· Plotai, kuriuose yra pakitusių ląstelių, pažymimi (rankiniu būdu arba kompiuteriu).
· Pakartotiniai mėginiai lyginami su ankstesniu mėginiu.
· Rezultatai pateikiami pagal tuo metu galiojančią Bethesdos sistemą.
· Vertintojai savo rezultatus dokumentuoja informacinėje sistemoje.
· Rezultatuose pateikiama informacija apie gimdos kaklelio mėginio kokybę.
· Vidinės kokybės kontrolės ataskaitose ir tyrimo rezultatuose nurodomi vertintojo, atlikusio pirminį mikroskopavimą, rezultatai.
Greitoji patikra (peržiūra)
· Atliekama mėginių, išskyrus tuos, kuriuos reikia vertinti pakartotinai, greitoji rankinė pakartotinė patikra arba automatizuota pakartotinė patikra.
· Greitoji rankinė pakartotinė patikra turi trukti maždaug 60–90 sekundžių. Peržiūrimas informatyviausias mėginio plotas.
· Greitąją patikrą atliekantys vertintojai turi būti įgudę ir išmokę atitinkamų su greitąja rankine ar automatine patikra susijusių vertinimo metodų.
· Vertintojai savo rezultatus dokumentuoja informacinėje sistemoje.
Atsitiktinė 10 proc. mėginių peržiūra
· Atsitiktinei peržiūrai atsitiktinai atrenkama 10 proc. mėginių, kuriuose nerasta patologinių pakitimų arba kurie yra neinformatyvūs.
· Vieno mėginio peržiūra trunka apie 6 min.
· Atsitiktinės peržiūros rezultatai dokumentuojami informacinėje sistemoje.
Pakartotinė peržiūra (antrinis patikros vertinimas)
Pakartotinai peržiūrimi tepinėliai, kuriuose biomedicinos technologas ar medicinos biologas įtarė esant intraepitelinių pokyčių, arba mėginiai, kuriuos anksčiau rekomenduota pakartoti. Pakartotinę peržiūrą atlieka gydytojas patologas.
Pakartotinai peržiūrimi ir kiti didelės rizikos mėginiai, atsižvelgiant į klinikinę informaciją arba paciento istoriją, įskaitant:
· mėginį be intraepitelinių pokyčių, jei prieš tai citologiniu ar histologiniu tyrimu buvo nustatyta intraepitelinių pakitimų;
· kliniškai įtartinus atvejus (nenormalios išskyros, kraujavimas po menopauzės, nenormalus ar įtartinas gimdos kaklelis);
· jei mėginyje randama intraepitelinių pakitimų, peržiūrimi 5 metų laikotarpio mėginiai be intraepitelinių pakitimų.
Rezultatai pateikiami pagal tuo metu galiojančią Bethesdos sistemą.
Rezultatuose nurodoma vertintojo, atsakingo už tyrimo rezultatą, tapatybė.
Patologinių mėginių peržiūra ir aptarimas
Visi mėginiai, kuriuose gydytojas patologas patvirtino intraepitelinius pokyčius, peržiūrimi visų vertintojų ir aptariami prie daugiagalvio mikroskopo.
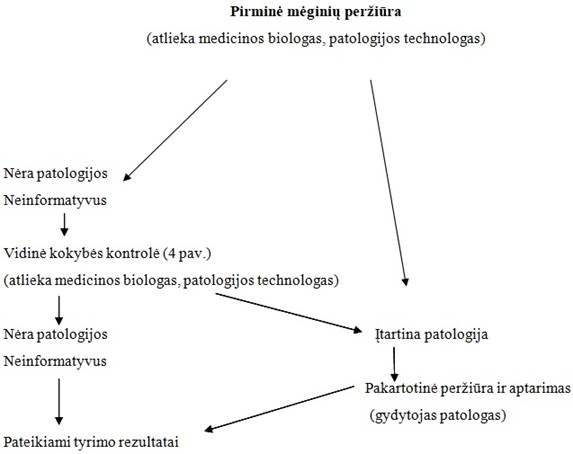
4.1.7.1 pav. Mikroskopavimo eiga
Vidinė mikroskopavimo kokybės kontrolė
Vertinimo tikslumas stebimas ir valdomas naudojant patvirtintus protokolus ir procedūras, skirtus nekokybiškos veiklos parametrams identifikuoti ir kontroliuoti.
Vidinę citologinės patikros kokybės kontrolę sudaro:
· pakartotinė mėginių, kurie atliekant pirminę patikrą buvo įvertinti kaip neigiami arba nepakankami, peržiūra. Jos tikslas – aptikti klaidingai teigiamus ar klaidingai neigiamus rezultatus, nustatyti mėginių vertinimo jautrumą ir specifiškumą;
· ataskaitų duomenų analizė pagal atskirus vertintojus ir tyrimų rezultatus (žymūs ir nežymūs intraepiteliniai pakitimai, mėginiai be intraepitelinių pakitimų, neinformatyvūs mėginiai) –procentinės dalies nustatymas ir palyginimas su visos laboratorijos, patikros programos rezultatais ir nacionaliniais standartais;
· kompetencijos kokybės vertinimas siekiant nustatyti vertintojus, kuriems trūksta žinių bei įgūdžių ir kuriems būtų reikalingi kvalifikacijos kėlimo mokymai (kursai);
· citologinių rezultatų koreliacija su klinikiniais ar histologiniais rezultatais;
· moterų, kurioms nustatytas invazinis vėžys, mėginių, kurie buvo tiriami mažiau nei prieš 3 ar 5 metus ir kurių tyrimo rezultatai neparodė intraepitelinių pakitimų arba buvo nustatyti tik nežymūs pakitimai, pakartotinė peržiūra;
· kokybės rodiklių stebėjimas ir analizė, remiantis patvirtintais kokybės reikalavimais (žr. 4.1.10 dalį).
4.1.8. Rezultatų įvertinimas ir pateikimas
Rezultatai pateikiami LIS, o iš jos perduodami į ESPBI IS/GKV PP posistemę. Sistema turi būti prieinama visiems laboratorijos darbuotojams.
LIS registruojami šie duomenys:
· paciento identifikaciniai duomenys;
· laboratorijos pavadinimas, adresas, įmonės kodas;
· mėginio pristatymo į laboratoriją data;
· tyrimo indikacijos: patikra, stebėjimas ar klinikinė indikacija;
· tyrimo tipas: citologinis ar histologinis;
· laboratorinio tyrimo rezultatai pagal tuo metu galiojančią Betesdos klasifikaciją;
· galutinio rezultato data;
· asmens ar asmenų, kurie įvertino mėginį, vardas ir pavardė.
Papildomi reikalavimai, taikomi LIS ir ESPBI IS/GKV PP posistemei:
· galimybė susieti kelis to paties paciento tyrimų rezultatus;
· prieiga prie informacijos apie ankstesnius pacientės gimdos kaklelio citologinių ir histologinių tyrimų rezultatus ir juos pateikusius specialistus;
· galimybė peržiūrėti ir analizuoti klinikinius rezultatus, įskaitant kolposkopijos duomenis ir kt.
Tyrimo rezultatai pateikiami į ESPBI IS GKV PP posistemę per 10 darbo dienų, skaičiuojant nuo mėginio patekimo į laboratoriją dienos. Jei nurodyto termino neįmanoma laikytis, apie tai reikia pranešti gydytojui.
Atsižvelgiant į nacionalinius teisinius reikalavimus, citologinio tyrimo rezultatus gali pasirašyti atsakingi biomedicinos technologai, medicinos biologai ir gydytojai patologai.
4.1.9. Citologinių tyrimų kokybės reikalavimai, susiję su archyvavimu ir saugojimu
Laboratorija turi užtikrinti tinkamą gimdos kaklelio tyrimo siuntimo formų (žiūrėti III skyriaus priedą Nr.1), mėginių ir rašytinių ir (arba) kompiuterinių tyrimo atsakymų administravimą ir saugų archyvavimą bei utilizavimą. Citologinių tyrimų mėginiai (stikleliai) saugomi specialiose spintose kambario temperatūroje.
Saugojimas ir archyvavimas:
· Gimdos kaklelio mėginiai tinkamomis sąlygomis saugomi ne mažiau kaip 10 metų.
· Siuntimo formos (žiūrėti III skyriaus priedą Nr.1) ir (arba) jų elektroniniai atitikmenys bei citologinio tyrimo mėginio atsakymo duomenys (popieriniai ar kompiuterinėje programoje) saugomi laikantis LR teisės aktų, nustatančių patologijos tyrimų kokybės reikalavimus.
· Visi duomenys ir mėginiai turi būti lengvai surandami ir reikalui esant pateikiami peržiūrai.
Citologinio tyrimo mėginių analitinis kokybės valdymas
Citologinio tyrimo mėginio vertinimo tikslumas stebimas naudojant iš anksto suderintus protokolus, siekiant apibrėžti ir kiek įmanoma sumažinti klaidos tikimybę. Kokybės kontrole siekiama gerinti tiek laboratorijos, tiek kiekvieno patikrą atliekančio asmens darbo kokybę.
Metodas, pagrįstas pakartotine mėginių peržiūra (kasdiene):
· greitasis mėginių (žr. 4.1.8 dalį „Mikroskopavimas“), įvertintų kaip be intraepitelinių pokyčių ar neinformatyvių, peržiūra. Santykinis pirminės peržiūros jautrumas turėtų būti ≥ 85 proc.;
· 10 proc. atsitiktinių mėginių be intraepitelinių pokyčių peržiūra. Šis metodas padeda sumažinti klaidingai neigiamų tyrimų skaičių.
Statistinė analizė:
· neinformatyvių mėginių procentinė analizė pagal ASPĮ, ėmėją ir neinformatyvumo priežastį (4 kartus per metus);
· nustatytos patologijos procentinė analizė susiejant tyrimą su jį atlikusiu asmeniu (4 kartus per metus);
· kasmetinė tarplaboratorinė procentinė patologijos analizė (laboratorijos rodiklių lyginimas su kitų laboratorijų rodikliais);
· kasmetinis laboratorijoje atliekamų tyrimų jautrumo ir specifiškumo, teigiamų ir neigiamų prognozinių rodiklių skaičiavimas.
Nuolatinė mėnesinė koreliacija:
· Citologinė, histologinė ir klinikinė
Citologinėje, biopsinėje medžiagoje ar per kolposkopiją radus žymių intraepitelinių pakitimų, peržiūrimi visi mėginiai be intraepitelinių pakitimų ar neinformatyvūs citologiniai mėginiai, paimti moteriai per paskutinius 3–5 metus. Rezultatai aptariami DDK. Radus nesutapimų, pildomas protokolas, išvada pakeičiama ir apie tai informuojamas mėginį ėmęs sveikatos priežiūros specialistas. Skirtingose laboratorijose atliktų tyrimų rezultatai ir mėginiai turėtų būti lengvai pasiekiami tiriančiam gydytojui.
· Citologinė ir ŽPV
Vidinės kontrolės rezultatų aptarimas DDK
Jei laboratorija ar GKV PP dalyvaujantis sveikatos priežiūros specialistas neatitinka keliamų reikalavimų, atliekama audito procedūra, kurios tikslas – patikrinti laboratorijos vidinės kokybės veiklos rodiklius. Per ateinančius metus laboratorija privalo pašalinti nustatytus trūkumus, jei reikia, suteikdama darbuotojams galimybę tobulinti savo įgūdžius. Kitaip ji negali dalyvauti GKV PP.
4.1.12. Išorinis kokybės vertinimas
Užtikrinimo struktūra:
· Išorinis tęstinis mokymas. Išorinis tęstinis mokymas apima šias formas:
e) mokslinių tyrimų vykdymas ir rezultatų publikavimas arba darbas atitinkamų medicinos draugijų komitetuose.
· Tarplaboratorinis statistinių rodiklių palyginimas
Laboratorijų darbo rodikliai skelbiami kasmet ir lyginami tarpusavyje ir turi būti prieinami kiekvienai patikroje dalyvaujančiai įstaigai.
· Keitimasis citologinių tyrimų mėginiais
Tarplaboratorinis keitimasis mėginiais ir rezultatų palyginimas yra naudingas didinant diagnostikos tikslumą ir atlieka edukacinę funkciją. Kad mėginių mainų programa gimdos kaklelio citologijos srityje būtų veiksminga, ji turėtų pasižymėti šiomis rekomenduojamomis savybėmis:
1) Peržiūra vykdoma vietiniu ar regioniniu pagrindu, kad laboratorijos mėginiais būtų galima keistis lengviau ir greičiau.
2) Mėginiai turi būti įvairūs, atitikti įprastą patikrą, įskaitant neinformatyvius mėginius ir citologinio tyrimo mėginius be intraepitelinių pakitimų.
4) Mėginius pirmiausia turi peržiūrėti ir įvertinti vienas ar keli pirminės patikros specialistai, po to gydytojas patologas.
6) Mėginiai, kurių tyrimo išvados nesutapo, turi būti aptariami tarplaboratoriniuose periodiniuose mikroskopavimo seminaruose, kuriuose dalyvauja dauguma darbuotojų.
· Išorinė patikros įgūdžių kontrolė (GKV PP MC)
Specialisto, atliekančio gimdos kaklelio patikrą, įgūdžiai ir patirtis turi įtakos laboratorijos rezultatų kokybei. Pakartotinis kvalifikacijos tikrinimas privalomas, kai asmuo, dalyvaujantis GKV PP, negalėjo atlikti mėginių vertinimo ≥ 6 mėn. arba metinė statistinė analizė rodo, kad teigiamas prognozinis rodiklis neatitinka 65–85 proc. intervalo.
Pakartotinis kvalifikacijos tikrinimas atliekamas po pakartotinių kursų, kurių trukmė – ne mažiau kaip 30 val. (įskaitant kontaktines ir nekontaktines valandas), organizuojant egzaminą.
Pakartotinio kvalifikacijos tikrinimo tikslas – objektyviai įvertinti pirminės patikros specialisto gebėjimą vertinti citologinio gimdos kaklelio tyrimo mėginius.
Pakartotinį kvalifikacijos tikrinimą sudaro:
2) praktinis testas: 10 tepinėlių peržiūra ir rezultatų pateikimas bei 20 pažymėtų plotų ląstelių pakitimų įvertinimas.
Testas įvertinamas teigiamai, kai teisingų atsakymų kiekviename etape yra daugiau nei 60 proc. Neišlaikiusiems testo asmenims neleidžiama dirbti GKV PP. Jiems rekomenduojami papildomi mokymai ir testas.
· Laboratorijos akreditacija
Tai neprivaloma išorinės laboratorijos kontrolės priemonė.
· Atsakomybė už kokybės kontrolę
Už kokybės kontrolę, darbo gairių ir procedūrų patvirtinimą atsakingas laboratorijos vadovas.
V SKYRIUS. ŽPV TYRIMo KOKYBĖS UŽTIKRINIMAS LABORATORIJOJE
5.1. ŽPV tyrimo kokybės reikalavimai ir standartai
Kokybės užtikrinimas teikiant paslaugas apima kokybės reikalavimų, parengtų pagal standartą LST EN ISO 15189:2012 „Medicinos laboratorijos. Kokybės ir kompetencijos reikalavimai“, laikymąsi. Kokybės reikalavimai pateikiami kaip aprašymas. ŽPV tyrimo kokybės standartai pateikiami kaip veiklos, kurios rezultatų lygį galima išmatuoti, apibūdinimas ir su ja susijęs tikslas.
5.2. Organizaciniai reikalavimai
5.2.1. Laboratorijos licencijavimas ir akreditavimas
· GKV PP programoje gali dalyvauti laboratorijos, kurioms Valstybinė akreditavimo sveikatos priežiūros veiklai tarnyba prie Sveikatos apsaugos ministerijos (SAM) yra išdavusi licenciją, suteikiančią teisę teikti laboratorinės diagnostikos ar patologijos tyrimų paslaugas, ir kuri papildomai atitinka šio dokumento reikalavimus.
· Laboratorijų licencijavimas vykdomas laikantis LR Laboratorinės diagnostikos paslaugų teikimo reikalavimų aprašo nuostatų. Įstaigai išduotoje licencijoje turi būti nurodyta, kad laboratorija gali atlikti būtent ŽPV molekulinės diagnostikos tyrimus.
· GKV PP taip pat gali dalyvauti laboratorijos, kurios yra akredituotos pagal ISO 15189:2012 standartą ir turi tai patvirtinantį dokumentą, kuriame nurodyta, kad ŽPV molekulinis tyrimo metodas yra akredituotas.
5.2.2. Laboratorijoje atliekamų tyrimų apimtis
GKV PP gali dalyvauti laboratorija, jau turinti ŽPV arba kitų infekcinių molekulinių tyrimų patirties:
· atlieka ne mažiau kaip 5000 ŽPV arba kitų infekcinių molekulinių tyrimų per metus;
· įdiegus GKV PP, vien ŽPV molekulinių tyrimų atlieka ne mažiau kaip 1000 per kiekvienus ateinančius metus.
5.2.3. Sveikatos ir saugos reikalavimų laikymasis
Laboratorija turi atitikti visus nacionalinius teisinius ir įstatymuose nustatytus sveikatos ir saugos reikalavimus. Kaip informacinis dokumentas rekomenduojamas Klinikinių ir laboratorijos standartų instituto (angl. Clinical and Laboratory Standards Institute – CLSI) dokumento „MM03. Užkrečiamųjų ligų molekulinės diagnostikos metodai“ trečiasis leidimas (MM03 Molecular Diagnostic Methods for Infections Diseases, 3rd Edition).
5.2.4. Kokybės vadybos sistema
· Laboratorijoje turi būti įdiegta kokybės vadybos sistema (KVS) ir parengtas kokybės vadovas. Laboratorija privalo vadovautis standarto ISO 15189:2012 nuostatomis ir kitais teisės aktais, Lietuvos ir tarptautinių laboratorinės medicinos organizacijų (Tarptautinės klinikinės chemijos ir laboratorinės medicinos federacijos (angl. International Federation of Clinical Chemistry and Laboratory Medicine, toliau – IFCC), Europos klinikinės chemijos ir laboratorinės medicinos federacijos (angl. European Federation of Clinical Chemistry and Laboratory Medicine, toliau – EFLM) ir kt.) gairėmis ir rekomendacijomis dėl laboratorinės diagnostikos paslaugų teikimo ir darbo organizavimo ASPĮ laboratorijoje.
· Kokybės vadove turi būti pateikta organizacijos valdymo ir vadybos struktūra, aiškiai nurodant laboratorijos vietą šioje struktūroje.
· Laboratorija turi turėti kokybės vadybos dokumentų sąrašą, dokumentų patvirtinimo, išleidimo, identifikavimo, naudojimo tvarkos aprašą, taip pat jų periodinės peržiūros ir atnaujinimo, negaliojančių dokumentų žymėjimo bei tvarkymo, dokumentų keitimų tvarkos aprašą, dokumentų valdymo principų aprašą, jei naudojami tik elektroniniai dokumentai.
· Laboratorija turi turėti ŽPV tyrimų atlikimo įrašų identifikavimo, gavimo, saugojimo, priežiūros, keitimo ir sunaikinimo tvarkos aprašą.
· Laboratorijoje turi būti parengti dokumentai, kuriuose apibrėžti laboratorijos patalpų, kuriose atliekamas ŽPV tyrimas, ir reagentų saugojimo vietų, aplinkos sąlygų techniniai reikalavimai bei šių reikalavimų laikymosi stebėjimą įrodantys dokumentai.
· Kokybės vadove turi būti aprašyta ŽPV patikrai naudojamų medicinos prietaisų ir bendrosios paskirties laboratorinių prietaisų įrengimo laboratorijoje, jų naudojimo, kalibravimo ir priežiūros tvarka.
· Kokybės vadove turi būti aprašyta ŽPV tyrimui naudojamų reagentų ir įvairių eksploatacinių medžiagų (dozatorių antgalių ir kt. papildomų priemonių) priėmimo, saugojimo, tinkamumo tikrinimo, atsekamumo ir atsargų valdymo tvarka.
· Kokybės vadove turi būti aprašyta, kokiais būdais užtikrinama ŽPV tyrimo atlikimo kokybė, kaip vykdoma laboratorinių tyrimų vidaus kokybės kontrolė ir išorinis kokybės vertinimas, veiksmų, kai gaunami nepatenkinami (klaidingi) kokybės kontrolės rezultatai, seka, gautų mėginių laikymo ir sunaikinimo tvarka.
· Kokybės vadove turi būti aprašyta neatitikčių nustatymo ir valdymo visuose kokybės vadybos sistemos lygmenyse, įskaitant iki tyrimo, tyrimo metu ir po tyrimo vykdomus procesus, duomenų apie nustatytas neatitiktis, atliktus korekcinius ir prevencinius veiksmus, registravimo tvarka.
· Kokybės vadove turi būti aprašyta, kaip nagrinėjami skundai, atsiliepimai ar kitokia neigiama informacija apie tyrimo rezultatą ar kitą laboratorijos veiklą, taip pat grįžtamasis ryšys, gautas iš gydytojų, pacientų, laboratorijos darbuotojų ir kitų šalių, ir kaip atsakoma skundo teikėjams.
· Kokybės vadove turi būti apibrėžtas laboratorijos informacinių technologijų sistemų bei programų tvarkymas ir naudojimas užtikrinant laboratorinių duomenų konfidencialumą, prieinamumą ir vientisumą, nustatytos visų laboratorijos darbuotojų, kurie naudojasi informacinių technologijų programomis, teisės ir atsakomybė.
· Darbuotojų, dirbančių su GKV PP, pareiginėse instrukcijose turi būti nustatyti minimalūs kvalifikaciniai reikalavimai – kvalifikaciją atspindintis išsilavinimas, mokymai, patirtis ir įgūdžiai, kurie reikalingi konkrečiai pareigybei ir yra tinkami GKV PP numatytoms užduotims atlikti.
· Laboratorijoje turi būti paskirtas už kokybės vadybą atsakingas asmuo, kuris palaikys ryšį su atsakingu GKV PP asmeniu, kad išspręstų visas kylančias su kokybe susijusias problemas.
· Laboratorijos kokybės vadybininko pareigas gali eiti asmuo, įvykdęs vieną iš šių sąlygų:
1. įgijęs laboratorinės medicinos gydytojo, medicinos biologo, medicinos genetiko profesinę kvalifikaciją ar aukštąjį universitetinį išsilavinimą, atitinkantį laboratorijos veiklos sritį, ir papildomai:
1.1. arba išklausęs kokybės vadybos mokymo programą (kursus), apimančią laboratorijos veiklos tarptautinius standartus, kokybės vadybos sistemas, vidaus auditą, kurios bendra trukmė – ne mažiau kaip 36 val.
2. Lietuvos Respublikos teisės aktų nustatyta tvarka įgijęs biomedicinos technologo profesinę kvalifikaciją ir įgijęs kokybės vadybos ar sveikatos priežiūros vadybos magistro laipsnį bei turintis ne mažesnę kaip 1 metų biomedicinos technologo darbo ASPĮ laboratorijoje patirtį;
3. įgijęs kokybės vadybos magistro laipsnį ir išklausęs ne mažiau kaip 36 val. laboratorinės medicinos mokymo programą (kursus) ar turintis ne mažesnę kaip 1 metų darbo ASPĮ laboratorijoje patirtį.
· Laboratorijos vadovo pareiginėje instrukcijoje turi būti nurodoma atsakomybė už kokybės vadybos sistemos planavimą ir vientisumą vykdant vadybos sistemos pakeitimus, laboratorijos darbo kokybišką organizavimą ir koordinavimą vykdant GKV PP, įgaliojimų arba atsakomybės paskyrimą darbuotojams, laboratorijoje parengtų procedūrų, ŽPV tyrimo procedūros ar metodikos aprašo, darbo instrukcijų tvirtinimą.
· Kokybės vadybininko pareiginėje instrukcijoje priskiriama atsakomybė ir įgaliojimai užtikrinti, kad kokybės vadybos sistemos procesai būtų nustatyti, įgyvendinami ir prižiūrimi.
· Darbuotojų pareiginėse instrukcijose turi būti apibrėžta atsakomybė, įgaliojimai ir užduotys, susiję su GKV PP.
5.2.5. Laboratorijos informacinė sistema, duomenų kaupimas, mainai, saugumas, formatas, tyrimų užsakymas
Laboratorijoje turi būti įdiegta ir veikti informacinė sistema (LIS), kurioje būtų galima kaupti su GKV PP susijusius duomenis ir generuoti reikiamas ataskaitas bei saugiai keistis duomenimis. LIS turi galėti išsaugoti ir perduoti į programos sistemą reikalingus duomenis reikiamu formatu.
Pageidautina, kad laboratorija galėtų ŽPV tyrimo užsakymą priimti ir ŽPV tyrimo rezultatus pateikti elektroniniu būdu. Naudoti „Profilaktinio GKV tyrimo siuntimo ir atsakymo formą“ (žiūrėti III skyriaus priedą Nr.1).
Laboratorija turi užtikrinti, kad tyrimų rezultatai būtų atskleidžiami tik asmenims, kurie yra įgalioti gauti ir naudoti medicininę informaciją. Pateiktų laboratorinių tyrimų rezultatų kopijos arba failai laboratorijoje turi būti saugomi taip, kad būtų galima greitai rasti informaciją. Pateiktų duomenų saugojimo trukmė negali būti trumpesnė, nei nustatyta teisės aktuose, tačiau rekomenduojama pateiktus rezultatus saugoti tiek laiko, kiek jie mediciniškai svarbūs.
5.3. Laboratorijos patalpoms taikomi reikalavimai
Laboratorija turi turėti pakankamai patalpų. Jos turi būti tinkamai išdėstytos ir leisti užtikrinti teikiamų paslaugų kokybę, laboratorijos darbuotojų sveikatą ir saugą.
Laboratorijos patalpos ir baldai turi atitikti LR higienos normas.
Bendrieji Lietuvos Respublikos higienos reikalavimai, taikomi laboratorijos patalpoms:
· patalpų apšvietimo reikalavimai, nustatyti LR patvirtintose higienos normose darbo vietų apšvietimui.;
· patalpų vėdinimo ir temperatūros reikalavimai, nustatyti LR patvirtintose higienos normose darbo patalpų šiluminiam komfortui ir pakankamai šiluminei aplinkai; triukšmo lygio reikalavimai, nustatyti LR patvirtintuose darbuotojų saugos ir sveikatos užtikrinimo taisės aktuose, skirtuose apsaugai nuo triukšmo keliamos rizikos reglamentuoti.
Stalų paviršiai turi būti lygūs, lengvai valomi, pagaminti iš chemikalams atsparios medžiagos.
Lubos ir grindys turi būti lygios, lengvai plaunamos, atsparios laboratorijoje naudojamoms plovimo, valymo ir sterilizacijos priemonėms.
Aplinkos temperatūra ir oro kokybė (mikroorganizmų kiekis, drėgmė, dulkių plitimo greitis ir kt.) turi nekenkti tyrimams. Įpučiamam orui filtruoti rekomenduojama filtrinė ventiliacijos sistema.
Tyrimams atlikti būtina mažai užteršta aplinka, darbo patalpose turi būti biologinės saugos spintos.
Turi būti numatytos vietos dokumentų, reikalingų dirbant su mėginiais, darbo protokolams laikyti.
Viršutinių drabužių ir asmeninių daiktų laikymo, valgymo ir gėrimo patalpos turi būti įrengtos ne darbo zonoje.
Laboratorijos patalpoms, kuriose atliekami GKV PP ŽPV tyrimai, taikomi reikalavimai:
2) ŽPV molekulinius tyrimus atliekanti laboratorija priskiriama prie antrosios biologinės saugos (Biosafety in Microbiological and Biomedical Laboratories (BMBL), 5th Edition, HHS Publication No. 21-1112, CDC) grupės zonos, todėl turi būti apsaugota nuo nepageidaujamų pašalinių asmenų patekimo ir nuo galimos biologinės taršos. Įėjimas į šias patalpas kontroliuojamas, pašalinių asmenų judėjimas yra minimalus ir tik su leidimu;
4) patalpos ribojasi sandariomis sienomis, kuriose nėra komunikacijų, o elektros įvadai suprojektuoti grindyse ar lubose;
7) jeigu dirbama ne su visiškai automatizuota ŽPV nustatymo sistema, ŽPV molekulinius tyrimus atliekančioje laboratorijoje yra atskirtos šios darbo patalpos:
5.4. Personalo kvalifikacijos reikalavimai
· Darbuotojų, dirbančių ŽPV tyrimus atliekančioje laboratorijoje, kvalifikacija turi atitikti Lietuvos Respublikos teisės aktuose nustatytus reikalavimus. Nesant kitais dokumentais reglamentuotos sveikatos priežiūros įstaigų laboratorinės medicinos specialistų profesinės kvalifikacijos tobulinimo tvarkos ir trukmės, laboratorinės medicinos gydytojams, gydytojams patologams ir gydytojams genetikams rekomenduojama profesinės kvalifikacijos tobulinimo trukmė – 120 val. per 5 metus, medicinos biologams – 80 val. per 5 metus, medicinos genetikams ir biomedicinos technologams – 60 val. per 5 metus.
· Laboratorinės medicinos specialistų profesinės kvalifikacijos tobulinimas Lietuvoje ar užsienyje vertinamas valandomis, kaip nustatyta LR patvirtintoje sveikatos priežiūros ir farmacijos specialistų profesinės kvalifikacijos tobulinimo ir jo finansavimo tvarkoje.
· Laboratorijai gali vadovauti laboratorinės medicinos gydytojas, gydytojas patologas arba medicinos biologas, turintys ne mažesnę kaip 1 metų laboratorinės diagnostikos paslaugų teikimo patirtį.
· Laboratorijoje, dalyvaujančioje GKV PP, turi dirbti arba laboratorinės medicinos gydytojas (-ai), gydytojas (-ai) patologas (-ai), gydytojas genetikas (-ai) arba medicinos biologas (-ai), medicinos genetikas (-ai). Laboratorijoje, kurioje dirba bent vienas iš išvardytų asmens sveikatos priežiūros specialistų, laboratorinės diagnostikos paslaugas taip pat gali teikti biomedicinos technologas (-ai), kuris negali GKV PP dirbti savarankiškai.
· Laboratorijos personalo einamos pareigos ir išsilavinimas turi atitikti ASPĮ pareigybių sąrašą.
· Kiekvienos pareigybės kvalifikaciniai reikalavimai, pareigos, teisės ir atsakomybė turi būti aprašyti pareiginiuose nuostatuose, patvirtintuose ASPĮ direktoriaus įsakymais.
Laboratorinės medicinos gydytojas, gydytojas patologas ir gydytojas genetikas turi:
· turėti LR galiojančią laboratorinės medicinos gydytojo, gydytojo patologo ar gydytojo genetiko licenciją;
· per 5 metus būti baigęs profesinio kvalifikacijos tobulinimo kursų programą (ne mažiau kaip 8 val. trukmės) ŽPV ir infekcinių molekulinių tyrimų tematika;
· pildyti laboratorijos dokumentus, diegti kokybės vadybos dokumentus;
· vertinti vidaus ir išorės kontrolės rezultatus, nustatyti neatitiktis, taikyti korekcinius veiksmus;
· suprasti ir mokėti atlikti ŽPV tyrimus ir interpretuoti tyrimų rezultatus;
· konsultuoti gydytojus akušerius-ginekologus tyrimų rezultatų vertinimo ir interpretavimo klausimais;
· dalyvauti gydytojų pasitarimuose;
· tobulinti profesinę kvalifikaciją LR sveikatos apsaugos ministro nustatyta tvarka.
Medicinos biologas, medicinos genetikas turi:
· per 5 metus būti baigęs profesinės kvalifikacijos tobulinimo kursų programą (ne mažiau kaip 8 val. trukmės) ŽPV ir infekcinių molekulinių tyrimų tematika;
· pildyti laboratorijos dokumentus, diegti kokybės vadybos dokumentus;
· vertinti vidaus ir išorės kontrolės rezultatus, nustatyti neatitiktis, taikyti korekcinius veiksmus;
· suprasti ir mokėti atlikti ŽPV tyrimus;
· tobulinti profesinę kvalifikaciją LR sveikatos apsaugos ministro nustatyta tvarka.
Biomedicinos technologas turi:
· dalyvauti gamintojo organizuojamuose mokymuose biomedicinos technologams;
· dalyvauti specialybinėse mokslinėse praktinėse konferencijose;
· dalyvauti atliekant vidaus ir išorės kokybės kontrolės užduotis;
· atlikti ŽPV molekulinius tyrimus nenukrypdamas nuo patvirtintų metodikų.
Kokybės vadybininkas turi:
· diegti kokybės vadybos dokumentus;
· užtikrinti, kad būtų nustatyti, įgyvendinami ir prižiūrimi kokybės vadybos sistemos procesai;
· organizuoti ir dalyvauti atliekant vidinį auditą.
Laboratorijos personalas, dirbantis su ŽPV technologija, turi turėti infekcinių molekulinių tyrimų patirties. Pradėdami darbą visi specialistai turi baigti mokymus, kurie apima:
· ėminių tvarkymą;
· tyrimo atlikimo ir laboratorijos aplinkos priežiūros procesus;
· analizę;
· kokybės kontrolę.
Tiekėjas turi išmokyti laboratorijos personalą dirbti su ŽPV tyrimo technologija. Turi būti pateikti įrodymai, kad:
· mokymai organizuojami vietoje;
· visi tyrimus atliekantys darbuotojai baigė mokymus ir turi baigtų mokymų pažymėjimą;
· saugoma dokumentacija, apibūdinanti personalo mokymo programą;
· vykdomas techninio personalo vertinimas ir kiekvieno darbuotojo darbo rezultatų stebėjimas remiantis pareigybės aprašu.
Darbuotojų vertinimą galima atlikti įvairiais būdais:
· stebint kasdienio darbo procesus ir procedūras, įskaitant taikomus saugos reikalavimus;
· stebint įrenginių priežiūrą ir veikimo tikrinimus;
· tikrinant tyrimo rezultatų registravimą (įrašus) ir perdavimą;
· tikrinant, kaip tiriami specialūs ėminiai, išorinės kontrolės medžiaga, padalintą ėminys ir kt.
5.5. Ėminių gabenimas, priėmimas, kokybės įvertinimas
5.5.1. Ėminių gabenimas
· Rekomenduojama ėminius gabenti specialiose gabenimo dėžutėse arba sudėtus į specialius konteinerius, kurie turi būti sandariai uždaromi, nedūžtantys, atsparūs dezinfekcinėms medžiagoms, nepralaidūs skysčiams. Konteineriai apsaugo ėminius nuo saulės šviesos, šalčio ar karščio. Ėminiai transportuojami sandariai uždaryti. Ant ėminio talpyklos nurodoma pacientę identifikuojanti žyma.
· Jeigu ėminius reikia gabenti išlaikant tam tikrą temperatūros režimą (pagal terpės gamintojo rekomendacijas), rekomenduojama naudoti termoizoliacines dėžes. Kai ėminiai gabenami didelį atstumą (> 100 km), siekiant išlaikyti griežtas temperatūros sąlygas rekomenduojama naudoti mobiliuosius kompresorinius šaldytuvus, kurie efektyviau palaiko tinkamą gabenimo temperatūrą.
· Gabenamiems ėminiams rekomenduojama naudoti įprastinį arba sausą ledą.
· Rekomenduojama registruoti šią kiekvieno gabenamo ėminio informaciją: ėminio išsiuntimo laikas ir data, ėminio priėmimo laikas ir data, duomenys, ar gabenamas ėminys buvo veikiamas netinkamų temperatūros svyravimų.
· Visi ėminiai yra potencialus infekcijos šaltinis, todėl rekomenduojama, kad personalas, atsakingas už ėminių gabenimą, naudotų visas reikiamas apsaugos nuo infekcijos priemones.
· Kartu su ėminiu arba elektroniniu būdu siunčiama išsamiai užpildyta „Profilaktinio GKV tyrimo siuntimo ir atsakymo forma“ (žiūrėti III skyriaus priedą Nr.1).
· Siuntimo formos arba lydraščiai (jei siuntimo forma elektroninė) sudedami į atskirą talpyklą ir gabenami į laboratoriją.
· Už ėminio paruošimą gabenti ir siuntimo formos užpildymą atsako jį siunčianti ASPĮ.
· Už tinkamų gabenimo sąlygų (temperatūra, gabenimo laikas ir kt.) užtikrinimą atsako ASPĮ.
5.5.2. Ėminių priėmimas ir kokybės įvertinimas
Gauti ėminiai laboratorijos registratūros darbuotojo apžiūrimi, įvertinama jų kokybė pagal šiuos kriterijus:
· Ar ėminys paimtas į tinkamą talpyklą (mėgintuvėlį);
· ar ėminys nėra išsiliejęs;
· ar talpykla tinkama naudoti (nėra suskilusi, nesandari, nepasibaigęs galiojimo laikas ir kt.);
· Ar ėminys gautas su siuntimu ir siuntimas užpildytas tinkamai;
· Ar ėminys tinkamai identifikuotas (sutampa duomenys ant ėminio talpyklos ir siuntime);
· ar siuntimas nėra gautas be ėminio;
· ar tinkamos ėminio gabenimo sąlygos (temperatūra, laikas ir kt.).
Esant ėminio neatitikimui įvykis registruojamas laboratorijos neatitikčių žurnale, susisiekiama su mėginį atsiuntusia ASPĮ. Nepavykus pašalinti neatitikties, ji registruojama nacionalinėje sistemoje. Ėminys sunaikinamas laboratorijoje nustatyta ir aprašyta tvarka.
Neradus pažaidų, ėminiai registruojami.
5.6. Ėminių registravimas ir pranešimas apie GKV PP patikrinimą
· Ėminį užregistravus laboratorijos informacinėje sistemoje (LIS), sugeneruojamas unikalus jo identifikacijos numeris, rekomenduojama, susietas su brūkšniniu kodu.
· Registruojama ėminio gavimo data, ėminį atsiuntusi ASPĮ ir jį paėmęs sveikatos priežiūros specialistas.
· Į LIS įvedami duomenys iš formos „Profilaktinio GKV tyrimo siuntimo ir atsakymo formą“ (žiūrėti III skyriaus priedą Nr.1).
· Ėminys ir formą (žiūrėti III skyriaus priedą Nr.1) turi būti paženklinti tuo pačiu identifikaciniu numeriu (užklijuojami brūkšniniai kodai).
· Pranešimas apie laboratorijoje gautą ir užregistruotą profilaktinės gimdos kaklelio patikros programos ėminį perduodamas į ESPBI IS GKV PP posistemę per 24 val. nuo ėminio gavimo arba nacionalinėje sistemoje registruojama neatitiktis.
5.7. ŽPV nustatymas
5.7.1. Reikalavimai ŽPV nustatymo metodui
GKV PP turi būti naudojami tik standartizuoti ŽPV tyrimų reagentų rinkiniai, validuoti klinikinių mėginių patikros tyrimams. Visi naudojami reagentai turi atitikti IVDD 98/79/EC, o nuo 2022-05-26 IVDR 2017/746 reikalavimus ir būti paženklinti CE ženklu.
Svarbus aspektas, norint naudoti patikros programose, yra ŽPV tyrimo jautrumas ir specifiškumas.
Tyrimo jautrumas (CIN2 ir vėlesnės stadijos displazijai, patikros programoms) turi būti ne mažiau kaip 95,0 proc.
Tyrimo specifiškumas (CIN2 ir vėlesnės stadijos displazijai, patikros programoms) turi būti ne mažiau kaip 84,0 proc.
Rekomenduojami AR ŽPV DNR nustatymu pagrįsti tyrimai, kuriais nėra nustatomas konkretus ŽPV tipas. Bendrai nustatomi ne mažiau kaip 13 AR ŽPV tipų (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68).
(Siūloma svarstyti bendro ŽPV tyrimo metodo pasirinkimo galimybę visuose GKV PP centruose)
5.7.2. ŽPV DNR išskyrimas
ŽPV DNR išskiriama automatizuotai.
Laboratorija pagal gamintojo rekomendacijas DNR išskyrimo būdą turi suderinti su naudojamu ŽPV nustatymo metodu.
· DNR išskyrimo sistemą turi sumontuoti gamintojo tiekėjo atstovai. Ji montuojama tinkamoje aplinkoje, kad būtų užtikrinamas rezultatų tikslumas ir užkertamas kelias užteršimui.
· Periodinę techninę priežiūrą turi atlikti išmokyti asmenys, kaip nurodyta gamintojo vartotojo vadove. Turi būti pildomas techninės priežiūros žurnalas.
· Išskirtą DNR galima saugoti šaldiklyje (–20°C temperatūroje). Reikėtų vengti kelių užšaldymo ir atšildymo ciklų.
· Tiriant mėginius (ruošiant ir išskiriant DNR) reikia stengtis jų neužteršti. Su kiekviena mėginių partija reikia paruošti bent vieną vandens mėginį. Vandens mėginys yra neigiamas išskyrimo kontrolės mėginys atliekant ŽPV tyrimus ir iki tyrimo atlikimo saugomas tomis pačiomis sąlygomis kaip ir tiriamųjų mėginių DNR ekstraktai.
· Pageidautina, kad DNR būtų laikoma Sarstedt mėgintuvėlyje su užsukamuoju dangteliu arba lygiaverčiame mėgintuvėlyje (vidinis tūris – 250 μl). Nepatartina naudoti mėgintuvėlių su užspaudžiamaisiais dangteliais, kurie gali sukelti taršą atidarant.
5.8. Tyrimo rezultatų įvertinimas ir patvirtinimas
· Atsakomybė už tyrimo atlikimą priskiriama biomedicinos technologui.
· Atsakomybė už ŽPV tyrimų įvertinimą ir patvirtinimą priskiriama laboratorinės medicinos gydytojui, gydytojui patologui, gydytojui genetikui arba medicinos biologui, medicinos genetikui.
· Atsakomybė turi būti aprašyta laboratorijos dokumentuose ir patvirtinta laboratorijos vadovo.
5.9. Tyrimo rezultatų valdymas
Tyrimo rezultatai pateikiami į LIS, kur patvirtinami laboratorinės medicinos gydytojo, gydytojo patologo, gydytojo genetiko, medicinos biologo arba medicinos genetiko ir perduodami į ESPBI IS GKV PP posistemę.
LIS registruojami šie duomenys:
· laboratorijos pavadinimas, adresas, įmonės kodas;
· paciento identifikaciniai duomenys (vardas ir pavardė amžius);
· tyrimą užsakiusio gydytojo vardas ir pavardė, kontaktiniai duomenys;
· ėminio paėmimo data;
· ėminio registravimo data,
· ėminio tipas;
· tyrimo pavadinimas;
· naudojamo metodo pavadinimas;
· tyrimo rezultatas;
· tyrimo atlikimo data;
· rezultatų ir protokolo išdavimą patvirtinančio (-ių) asmens (-ų) identifikaciniai duomenys;
· protokolo parengimo data ir laikas.
Papildomi reikalavimai, taikomi LIS ir ESPBI IS GKV PP posistemei:
· galimybė susieti kelis to paties paciento tyrimų rezultatus;
· prieiga prie informacijos apie ankstesnius pacientės gimdos kaklelio citologinių ir histologinių tyrimų rezultatus ir juos pateikusius specialistus;
· galimybė peržiūrėti klinikinius rezultatus, įskaitant kolposkopijos duomenis ir kt.
Tyrimo rezultatai pateikiami į ESPBI IS GKV PP posistemę per 10 darbo dienų, skaičiuojant nuo ėminio patekimo į laboratoriją dienos. Jei nurodyto termino neįmanoma laikytis, apie tai reikia pranešti tyrimą užsakiusiam gydytojui.
Atliktų tyrimų rezultatų protokolai pasirašomi tyrimą atlikusio biomedicinos technologo ir tyrimą įvertinusio laboratorinės medicinos gydytojo arba gydytojo patologo, arba gydytojo genetiko, arba medicinos biologo, arba medicinos genetiko dedami vardiniai spaudai. Atliktų tyrimų rezultatai, kurie teikiami elektroniniu būdu, patvirtinami saugiu elektroniniu parašu, patvirtintu kvalifikuotu sertifikatu. Protokolai segami į segtuvus ir saugomi su kitais dokumentais. Turėtų būti numatyta ir elektroninių dokumentų kopijų valdymo sistema užtikrinanti greitą reikalingo dokumento paiešką.
5.10. Saugojimas ir archyvavimas (ėminių, užsakymų, rezultatų ir kt.)
Tyrimų rezultatų atsekamumui užtikrinti laboratorija turi parengti procedūrą, kuri leistų identifikuoti, saugoti ir saugiai šalinti pirminius ėminius ir mėginius. Laboratorija turi nustatyti ėminių ir mėginių saugojimo trukmę. Saugojimo trukmė turi būti apibrėžta pagal pirminio ėminio kilmę, užsakytus tyrimus ir taikomus reikalavimus.
Ėminiai turi būti gabenami ir saugomi terpių gamintojo nurodytomis sąlygomis:
· STM (Qiagen). Kambario temperatūroje gali būti laikoma iki 14 dienų, šaldytuve (+4 °C temperatūroje) – tris savaites. Norint laikyti ilgiau, užšaldoma –20 °C temperatūroje.
· PreservCyt (Hologic). Kambario temperatūroje gali būti laikoma iki 14 dienų, šaldytuve (+4 °C temperatūroje) – mažiausiai tris mėnesius. Šaldyti nerekomenduojama, nors ląstelės gali būti granuliuojamos ir laikomos –20 C temperatūroje.
· SurePath (TriPath Imaging). Kambario temperatūroje gali būti laikoma iki 14 dienų, šaldytuve (+4 °C temperatūroje) – mažiausiai tris mėnesius. Šaldyti nerekomenduojama.
· Kitos virusų transportavimo terpės. Ėminiai gabenami ir saugomi gamintojų nurodytomis sąlygomis.
DNR ekstraktai saugomi užšaldyti (–20 °C temperatūroje) tiek, kiek numatyta laboratorijos mėginių saugojimo tvarkos apraše.
Laboratorijoje archyvuojami ir saugomi atliktų tyrimų protokolai, įrašai, užsakymų formos pagal nacionalinės teisės aktų reikalavimus: laboratorinių tyrimų rezultatai saugomi ASPĮ vadovo nustatyta tvarka, bet ne trumpiau kaip 10 metų, laikantis LR patvirtinto laboratorinės diagnostikos paslaugų teikimo reikalavimų aprašo.
5.11. Kokybės užtikrinimas ir gerinimas (vidinė ir išorinė kokybės kontrolė)
5.11.1. Vidinė kokybė kontrolė
Laboratorinių tyrimų vidinė kokybės kontrolė – tai priemonių sistema, padedanti įvertinti tyrimų rezultatų teisingumą, tikslumą, glaudumą, pakartojamumą ir atkuriamumą ir orientuota į tyrimo atvejo duomenų interpretavimą, sisteminimą, klasifikavimą, priežastinių, funkcinių, struktūrinių ryšių nustatymą.
Vidinės kokybės kontrolės periodiškumas ir metodai turi būti nurodyti laboratorijos vadovo patvirtintame dokumente, kuriame nustatoma laboratorinių tyrimų kokybės užtikrinimo tvarka.
Siekiant įvertinti rezultatų teisingumą reikia atlikti šiuos veiksmus:
· jei atliekamas ŽPV tikralaikis PGR tyrimas – su kiekviena tiriamų mėginių grupe tirti kontrolinius mėginius, esančius reagentų rinkiniuose (paruošti gamintojo);
· pasikeitus rinkinio serijai, atliekant ŽPV PGR arba DNR tyrimą kartu ištirti žinomai teigiamą ir neigiamą mėginius;
· įsitikinti, kad vidinės kokybės kontroliniai mėginiai atitinka šiuos reikalavimus:
5.11.2. Išorinis kokybės vertinimas
Laboratorija turi dalyvauti tarplaboratorinių palyginimų programose (tokiose kaip išorinės kokybės vertinimo (IKV) programos, palyginamųjų tyrimų (PT) programos), tinkamose tyrimui, tyrimo rezultatams ir tyrimo rezultatams aiškinti. Kiekviena laboratorija turi planuoti, pasirinkti ŽPV tyrimų kokybės valdymo patikrinimą, t. y. dalyvavimą IKV programose pagal laboratorijoje parengtą programą.
Išorinės kokybės kontrolės sistemos tikslai – remiantis periodinių matavimų rezultatų nuokrypiu patvirtinti, kad laboratorijos rezultatai atitinka kokybės reikalavimus.
Dažniausiai IKV ir PT programų paskirtis, be kita ko, yra tokia:
· įvertinti laboratorijose atliekamų tyrimų arba matavimų kokybę, vykdyti laboratorijų darbo kokybės stebėseną;
· nustatyti galimas laboratorinių tyrimų atlikimo problemas, inicijuoti gerinimo veiksmus;
· suderinti tyrimo metodus ir siekti maksimalaus jų efektyvumo;
· nustatyti tarplaboratorinius skirtumus;
· remiantis gautais rezultatais, gerinti personalo kvalifikaciją;
· įvertinti atitiktį laboratorijos nustatytai matavimų neapibrėžčiai;
· įvertinti tyrimo metodo kokybės charakteristikas;
· priskirti reikšmes paliudytosioms pamatinėms medžiagoms ir nustatyti jų tinkamumą naudoti specifiniams tyrimams arba tyrimų procedūroms;
· kontroliuojančioms institucijoms įrodyti laboratorijos kompetenciją atlikti tinkamos kokybės tyrimus.
Tarplaboratorinius palyginamuosius tyrimus galima vykdyti nacionaliniu mastu, su kitomis asmens sveikatos priežiūros įstaigų laboratorijomis keičiantis mėginiais.
IKV mėginiai turi būti tiriami darbuotojų, kurie įprastai atlieka pacienčių mėginių tyrimą naudodami tas pačias procedūras, kurios naudojamos pacienčių ėminių.
Dalyvavimas IKV turi būti analizuojamas ir aptariamas su tiesiogiai susijusiais darbuotojais.
Kai gaunami nepatenkinami rezultatai (t. y. nustatoma neatitikčių):
· darbuotojai turi dalyvauti įgyvendinant ir registruojant korekcinius veiksmus;
· jei laboratorijos gauti IKV rezultatai neatitinka IKV programų organizatorių nustatytų rezultatyvumo kriterijų (nustatoma neatitiktis), laboratorija privalo atlikti neatitikties priežasties analizę, numatyti ir įgyvendinti korekcinius ir prevencinius (jei reikia) veiksmus ir stebėti jų rezultatus, pakartotinai dalyvaudama IKV, kol bus gauti rezultatyvumo kriterijus tenkinantys rezultatai;
· turi būti vertinamas korekcinių veiksmų rezultatyvumas, siekiant nustatyti tendencijas, potencialias neatitiktis ir imtis prevencinių veiksmų.
Laboratorija, pasirinkdama IKV paslaugos teikėją, turi įvertinti jo atitiktį šiems reikalavimams ir remtis IKV paslaugų teikėjų hierarchija:
· IKV arba PT paslaugų teikėjas yra akredituotas pagal LST EN ISO/IEC 17043: 2010 standarto „Atitikties įvertinimas. Bendrieji tyrimų kokybės vertinimo reikalavimai“ reikalavimus;
· IKV arba PT paslaugų teikėjas yra PSO;
· IKV arba PT paslaugų teikėjas yra Europos organizacijų, teikiančių IKV paslaugas laboratorinei medicinai (angl. European group of organisations involved in the external quality assessment of laboratory medicine – EQALM), narys arba asocijuotasis narys;
· IKV arba PT paslaugų teikėjas yra įgaliotas nacionaliniu mastu vykdyti IKV programas;
· IKV arba PT paslaugų teikėjas yra tarptautiniu mastu pripažinta organizacija (CAP, EFLM ir kt.);
· IKV arba PT paslaugų teikėjas yra reagentų ir (arba) in vitro diagnostikos medicinos priemonių (prietaisų) gamintojas;
IKV programose laboratorija, vykdanti GKV PP, turi dalyvauti bent du kartus per metus.
Gauti IKV tyrimų originalių protokolų duomenys ir IKV programų organizatorių statistinės ataskaitos saugomi ne trumpiau kaip 5 metus nuo in vitro diagnostikos medicinos priemonės (prietaiso), kuria atlikti tyrimai, eksploatacijos pabaigos dienos. Jeigu tyrimai atlikti rankiniais ar jiems prilygstančiais tyrimo metodais, protokolų duomenys saugomi 5 metus nuo tyrimų atlikimo dienos.
VI SKYRIUS. HISTOLOGINIS TYRIMAS IR JO KOKYBĖS UŽTIKRINIMAS LABORATORIJOJE
6.1. Įžanga
Pagrindinis patikros metodas yra gimdos kaklelio citologinis tyrimas. Kolposkopija nustatomos labiausiai pažeistos gimdos kaklelio sritys. O histologinis tyrimas patvirtina gimdos kaklelio intraepitelinius pokyčius, kuriais grindžiamas tolesnis gydymo planavimas.
Be to, histologinis tyrimas:
· yra citologijos ir kolposkopijos kokybės kontrolės „auksinis standartas“;
· atliekamas moterims pagal šiame dokumente pateiktus diagnostikos ir gydymo algoritmus;
· padeda diagnozuoti invazines karcinomas;
· prisideda prie laboratorijų veiklos ir kokybės vertinimo (jo duomenys saugomi ir naudojami šiam tikslui).
Skiriami trys histologinio tyrimo etapai:
1) ėminio paėmimas, gabenimas ir gavimas laboratorijoje (preanalitinis etapas);
histologinio tyrimo rezultatų tikslumas priklauso nuo ėminių, gautų kolposkopijos metu atlikus biopsiją (prireikus – endocervikalinio kiuretažo metodu) arba konizaciją, tinkamos kokybės;
2) ėminių apdorojimas ir interpretavimas (analitinis etapas);
tinkamas makroskopinio tyrimo aprašymas, techninis medžiagos parengimas, mikroskopinio tyrimo interpretavimas (nuo to priklauso tikslus histologinis rezultatas);
6.2. Histologinio tyrimo kokybės reikalavimai ir standartai
Įstaigos ar laboratorijos kokybiniai reikalavimai ir standartai turi atitikti LR galiojančius teisės aktus.
6.2.1. Organizaciniai reikalavimai.
Laboratorijos licencija
Gimdos kaklelio histologiniai tyrimai atliekami įstaigose, kurios turi patologijos tyrimų veiklos licenciją ir atitinka LR patvirtintus patologijos tyrimų kokybės reikalavimus.
Pastaba: laboratorijos licencija gaunama atlikus laboratorijos išorės auditą, per kurį vertinama personalo kvalifikacija, mokymas ir kompetencija, patalpų ir įrangos tinkamumas, laboratorijos informacinės sistemos ir kokybės vadybos sistemos. Pakartotinis licencijavimas atliekamas praėjus trejiems metams po pirmosios licencijos išdavimo, po to – kas penkerius metus. Laboratorijos akreditacija yra savanoriška.
Atitiktis sveikatos saugos reikalavimams
Laboratorija turi atitikti visus nacionalinius įstatymus ir įstatymuose nustatytus sveikatos saugos reikalavimus.
Kokybės vadybos sistema (KVS)
Laboratorijoje turi būti įdiegta kokybės vadybos sistema (KVS) ir paskirtas už kokybę atsakingas asmuo, kuris palaikys ryšį su GKV PP KC ir spręs visas galinčias kilti kokybės problemas. Informacija apie bet kokius neatitikimus, susijusius su patologijos laboratorija, turi būti perduodama GKV PP KC.
Laboratorijos informacijos sistema (LIS)
· Bendrieji reikalavimai: laboratorijoje turi būti įdiegta ir veikti tinkama laboratorijos informacijos sistema. Dirbti su LIS gali tik su tyrimais susijęs personalas. LIS turi būti prieinama periodinėms kokybės patikroms.
· Duomenų saugojimas: asmens duomenys, tyrimo duomenys ir išvados LIS turi būti saugomi pagal nacionalinius įstatymus.
· Ataskaitų teikimas: esant poreikiui, LIS turi pateikti tyrimų rezultatus, įskaitant su tyrimu susijusio personalo tapatybės duomenis.
· LIS turi susieti to paties paciento kelių tyrimų rezultatus, suteikti lengvą prieigą prie informacijos apie ankstesnius pacientės gimdos kaklelio histologinius tyrimus ir pateikti duomenis, reikalingus GKV PP KC.
6.2.2. Laboratorijos įrangos kokybės reikalavimai
Patalpos ir baldai turi atitikti Lietuvos Respublikos higienos normas. Visos laboratorijos turi būti aprūpintos tinkama įranga. Tai apima tinkamai paruoštas mėginių priėmimo, pjaustymo, tvarkymo, rezultatų pateikimo, spausdinimo vietas. Laboratorija turi būti įrengta taip, kad visas funkcijas būtų galima tinkamai atlikti laikantis darbo vietos saugos ir higienos standartų, kad darbo vietos būtų ergonomiškos, apsaugančios nuo pasikartojančių judesių sukeliamų padarinių (žr. 4.1.1 dalį).
6.2.3. Personalo kokybės reikalavimai
Mokslo, medicinos ir ne medicinos personalas turi būti licencijuotas arba išmokytas dirbti pagal reikalavimus. Visa įranga turi būti prižiūrima ir naudojama tik kompetentingų laboratorijos darbuotojų, kurie išmano terminologiją ir geba naudotis kompiuterinėmis sistemomis. Patologijos laboratorijai turi vadovauti technologas. Skyriui ar padaliniui turi vadovauti gydytojas patologas. Kiekvieno darbuotojo pareigos turi būti aprašytos laboratorijos kokybės vadove. Visi laboratorijos specialistai privalo dalyvauti tęstiniuose mokymuose.
Patologai turi:
· turėti LR galiojančią gydytojo patologo licenciją;
· dalyvauti bendruose gydytojų aptarimuose DDK;
· būti susipažinę su kokybės kontrolės sistema;
· atlikti atvejų peržiūrą, kai aptinkama nesutapimų tarp morfologinio ir klinikinio vaizdo, ir, esant neatitikimui, koreguoti diagnozę;
· dalyvauti rengiant ir atnaujinant rekomendacijas dėl (tęstinio) personalo mokymo;
· dalyvauti kokybės užtikrinimo programose, įskaitant metinės citologinių ir histologinių tyrimų rezultatų ataskaitos rengimą.
6.2.4. Ėminio priėmimas, registracija ir pranešimas apie tyrimą
Gimdos kaklelio ėminiai pristatomi į laboratoriją su tinkamai užpildytu popieriniu ar elektroniniu siuntimu (formą žiūrėti III skyriaus priedą Nr.1).
Ėminiai priimami, jei indelyje yra užpilti 10 proc. buferiniu formalino tirpalu, kurio tūris 10 kartų didesnis už ėminio tūrį. Siuntime pateikti duomenys turi atitikti pristatytą medžiagą. Žyma indelio etiketėje ir siuntime turi sutapti. Siuntime nurodomas indelių kiekis su nurodyta paėmimo lokalizacija turi atitikti pristatytų indelių kiekį. Medžiaga, atitinkanti nurodytus reikalavimus, registruojama LIS:
· Užregistravus ėminį LIS, ėminiui jam turi būti suteikiamas unikalus identifikacinis numeris, rekomenduojama, susietas su brūkšniniu kodu.
· Registruojama ėminio gavimo data, ėminį atsiuntusi ASPĮ ir jį paėmęs sveikatos priežiūros specialistas.
· Tiek siuntimas, tiek ėminys turi būti paženklinti tuo pačiu identifikaciniu numeriu.
· Į LIS įvedami duomenys iš siuntimo formos (žiūrėti III skyriaus priedą Nr.1).
· Kiekviena ASPĮ turi turėti pastovų prisijungimo prie ESPBI IS GKV PP posistemės kodą, kad galėtų stebėti savo siųstų ėminių tyrimo rezultatus.
· Pranešimas apie laboratorijoje gautą ir užregistruotą profilaktinės gimdos kaklelio patikros programos ėminį perduodamas į ESPBI IS GKV PP posistemę per 24 val. nuo gavimo laiko.
Ėminys laikomas netinkamu, jei:
e) kt.
Jei nustatoma, kad mėginys netinkamas, įvykis registruojamas laboratorijos neatitikčių registre ir susisiekiama su jį pateikusia ASPĮ. Nepavykus išspręsti neatitikties, ėminys grąžinamas ASPĮ ir apie tai informuojamas ėminį paėmęs sveikatos priežiūros specialistas. Atvejis registruojamas LIS ir informacija pateikiama į ESPBI IS GKV PP posistemę.
6.2.5. Makroskopinis vertinimas
Histologinio tyrimo ėminius makroskopiškai tiria gydytojas patologas pagal standartines gimdos kaklelio histologinio tyrimo metodines rekomendacijas. Histologinio tyrimo mėginių ženklinimas ant kasečių ir LIS turi sutapti su siuntime pateikta ėminių numeracija. Atlikdamas makroskopinį tyrimą gydytojas patologas privalo su ėminiais elgtis atsargiai (nenaudoti pincetų su aštriais danteliais, netraiškyti ir t. t.), kad būtų išvengta paviršiaus ar ėminio vientisumo pažeidimų.
Gimdos kaklelio biopsija
Makroskopinio tyrimo apraše nurodomas fragmentų skaičius ir jų matmenys, spalva, konsistencija. Biopsiniai mėginiai iš skirtingų gimdos kaklelio sričių dedami į skirtingas kasetes. Tyrimo metu į kasetes sudedamas visas gautas histologinio tyrimo ėminys.
Endocervikalinis kiuretažas
Išmatuojamas bendras ėminio dydis. Visi audiniai sudedami taip, kad būtų išvengta audinių praradimo.
Gimdos kaklelio kūginė biopsija
Ėminių rezekciniai kraštai ženklinami specialiais dažais, kad būtų galima įvertinti naviko plitimą. Makroskopinio tyrimo apraše nurodomas ėminio dydis (trys matmenys), gimdos kaklelio kanalo vieta (centrinė, paracentrinė ar kraštinė), matomos pažaidos, ženklinimo vietos, padedančios orientuoti ėminį. Preparuojama taip, kad kuo daugiau dengiamo epitelio patektų į histologinį preparatą. Tyrimo metu į kasetes sudedama visas gautas histologinio tyrimo ėminys ir nurodoma audinio paėmimo lokalizacija kiekvienoje kasetėje. Gimdos kaklelio konizacijos ir gimdos histerektomijos atvejais dedama bent po 3 gabaliukus iš kiekvieno kaklelio kvadranto.
Ekscizinė biopsija – tai kūgio formos gimdos kaklelio audinio dalies, įskaitant apatinę endocervikalinio kanalo dalį ir išorinę gimdos kaklelio dalį, paėmimas. Ekscizinės biopsijos apima konizaciją šaltu peiliu, lazeriu ir transformacijos zonos didžiosios kilpos eksciziją.
Histerektomija
Rezekcijos kraštai tinkamai ženklinami (gimdos kaklelio, parametro ir kt. kraštai). Bet kokia matoma pažaida išmatuojama ir aprašoma. Medžiagos makroskopinis preparavimas atliekamas pagal protokolą, kuriame nurodytas ėminių skaičius paimamas iš tam tikrų vietų, ėminių ėmimas, iš patologinio proceso vietos ir t. t.
6.2.6. Ėminio paruošimas ir įliejimas
Laboratorijoje taikomos standartizuotos ėminių paruošimo ir įliejimo į parafiną procedūros. LIS saugomi įrašai apie visus audinių apdorojimo etapus. Įliejimo metu ėminius reikia orientuoti taip, kad histologinio tyrimo mėginyje būtų kuo daugiau dengiamo epitelio.
Išsamus šių procedūrų aprašas pateikiamas laboratorijos kokybės vadybos sistemoje.
6.2.7. Ėminio parafininių blokų pjovimas
Gimdos kaklelio biopsijos, kūginės biopsijos ir endocervikalinio kiuretažo bei histerektomijos atvejais iš kiekvieno parafininio bloko pjaunama po vieną pjūvį iki reikiamo gylio, kad būtų matoma daugiausia dengiamo epitelio. Pjūvio storis 2–4 mikronai. Prireikus atliekami papildomi, gilesni mėginio pjūviai.
6.2.8. Histologinio tyrimo mėginių dažymas
Mėginiai dažomi hematoksilino ir eozino dažymo metodu pagal gamintojo rekomendacijas. Prireikus naudojami papildomi histocheminiai dažymo metodai ar imunohistocheminiai. Laboratorijoje privaloma kasdienė vidinė dažų paruošimo ir dažymo kokybės patikra.
Mikroskopavimas
Histologinio mėginio tyrimą atlieka gydytojas patologas. Mikroskopuojama binokuliniu mikroskopu, kuriame yra 2, 4, 10, 20, 40 kartų didinimo objektyvai ir 10 kartų didinimo okuliarai, kad būtų galima įvertinti audinio architektoniką ir ląstelės pokyčius.
Rezultatų pateikimas
Rezultatai apima šią informaciją:
· pacientės identifikaciniai duomenys;
· laboratorijos pavadinimas, adresas, įmonės kodas;
· ėminio paėmimo data;
· ėminio registracijos laboratorijoje data;
· operacijos ar ėminio ėmimo tipas;
· makroskopinės ir mikroskopinės analizės aprašai;
· standartizuota ICD-0 nomenklatūra ar TLK-10 kodai;
· galutinio histologinio mėginio tyrimo rezultatas, data ir vertinimą atlikusio gydytojo patologo vardas, pavardė ir parašas.
Navikai ir išplitimas nurodomi remiantis PSO klasifikacija (WHO Classification of Tumours of Female Reproductive Organs, 2013), FIGO rekomendacijomis (XXII FIGO World Congress of Gynecology and Obstetrics 2018).
Rezultatuose nurodomos visos rastos plokščiojo epitelio (nežymūs pakitimai, žymūs pakitimai, karcinoma in situ, invazinė karcinoma) ir (arba) liaukinio epitelio (žymūs pakitimai, adenokarcinoma in situ, invazinė adenokarcinoma) pažaidos. Esant invaziniam procesui, nurodomas invazijos dydis, santykis su operaciniais kraštais. Taip pat rezultatuose nurodomi visi kiti rasti patologiniai procesai (uždegimas, opėjimas ir kt.).
Smulkių histologinių mėginių tyrimo rezultatai pateikiami į LIS per 5 darbo dienas, stambių operacinių medžiagų ar sudėtingų atvejų – per 15 darbo dienų nuo ėminio registracijos laboratorijoje datos. Iš LIS rezultatai perduodami į ESPBI IS GKV PP posistemę.
Mėginio tyrimo rezultatų pateikimas gydytojams ar klinikoms
Mėginio tyrimo rezultatai pateikiami ėminį siuntusiam gydytojui ginekologui. Laboratorija užtikrina, kad būtų įdiegtas tinkamas rezultatų pateikimo mechanizmas.
6.2.10. Archyvavimas
Laboratorija užtikrina tinkamą gimdos kaklelio tyrimo siuntimo formų (žiūrėti III skyriaus priedą Nr.1), histologinių preparatų, parafininių blokų, rašytinių ir (arba) kompiuterinių tyrimo atsakymų administravimą ir saugų archyvavimą bei utilizavimą.
Saugojimas ir archyvavimas:
· Gimdos kaklelio histologiniai preparatai, parafininiai blokai tinkamomis sąlygomis saugomi ne mažiau kaip 10 metų.
· Siuntimo formos (žiūrėti III skyriaus priedą Nr.1) ir (arba) jų elektroniniai atitikmenys bei histologinio tyrimo atsakymo duomenys (popieriniai ar kompiuterinėje programoje) saugomi 10 metų.
· Visi duomenys, histologiniai preparatai, parafininiai blokai turi būti lengvai surandami ir prireikus pateikiami.
6.2.11. Kokybės užtikrinimas ir nuolatinis tobulinimas
Vidinė kokybės kontrolė
Rezultatų pateikimas labai priklauso nuo personalo kvalifikacijos, laboratorijos įrangos ir mėginių paruošimo. Medžiagos paruošimo kokybė turi įtakos rezultatų tikslumui.
Vidaus kokybės kontrolė gali būti vykdoma šiais metodais:
· kasdienis laboratorijos veiklos vertinimas;
· histologinės diagnozės koreliacijos su klinikine ar citologine diagnoze, neatitikčių registracija ir nagrinėjimas;
· dalyvavimas DDK;
· histologinių tyrimų ir rezultatų statistinė analizė:
c) nuolatinė mėnesinė citologinės ir histologinės koreliacijos analizė.
Išorinė kokybės kontrolė
Išorinis tęstinis mokymas
Išorinis tęstinis mokymas apima:
· dalyvavimą seminaruose ir simpoziumuose;
· dalyvavimą regioniniuose tarplaboratoriniuose mėginių peržiūros posėdžiuose;
· dalyvavimą tikrinant kvalifikaciją;
· pirminės patikros vertintojų, patologijos rezidentų rengimą;
· mokslinių tyrimų vykdymą ir rezultatų publikavimą arba darbą atitinkamų medicinos draugijų komitetuose.
Histologinių preparatų peržiūra
Esant klinikinių duomenų ir morfologinių rezultatų neatitikimui, histologiniai mėginiai peržiūrimi. Nustačius gimdos kaklelio vėžį peržiūrimi visi prieš tai tirti histologiniai mėginiai.
Nepriklausoma trečiųjų šalių peržiūra
Laboratorija privalo pateikti visus pacientės mėginius nepriklausomai trečiosios šalies peržiūrai pareikalavus GKV PP KC.
6.2.12 Klinikinių patologijos konferencijų (KPK) ir daugiadalykių konsiliumų (DDK) posėdžiai
DDK posėdžiuose gali būti svarstomi įvairūs neatitikimai tarp citologijos, histologijos ir klinikinių vaizdų.
Dalyvavimas KPK ir DDK posėdžiuose
Patologai (su kitais darbuotojais ar be jų) yra būtini KPK ir DDK posėdžių dalyviai. KPK ir DDK posėdžius šaukia ir organizuoja programos koordinatoriai. Posėdžio vieta, laikas ir dažnumas gali skirtis. Už atvejo parinkimą pirmiausia atsakingos klinikų komandos. Laboratorijos prašomos pateikti diskusijoms abejotinus ar neaiškius atvejus. Posėdžiams reikia pasiruošti.
KPK ir DDK posėdžių protokolas
Dalyvavimą, įskaitant pasirašytą dalyvavusio personalo sąrašą, sprendimus, įrašo GKP PP paskirtas asmuo. Posėdžių dalyviai privalo laikytis konfidencialumo ir asmens duomenų apsaugos reikalavimų.
Atvejo parinkimas
Siekiant užtikrinti veiksmingą KPK ir DDK posėdžių eigą, atvejus parenka už pacientę tyrimą atlikęs kolposkopuotojas.
VII SKYRIUS. DIAGNOSTINIS IŠTYRIMAS KOLPOSKOPIJOS METODU
7.1. Įžanga
Kolposkopija – tai instrumentinis tyrimas vulvos, makšties ir gimdos kaklelio pokyčiams įvertinti binokuliniu optiniu prietaisu vaizdą padidinus nuo 3,5 iki 40 kartų. Kolposkopija padeda tiksliau surasti ir įvertinti vulvos, makšties ir gimdos kaklelio epitelių pokyčių laipsnį, išplitimą, nustatyti tinkamiausią biopsijai vietą, radikaliai pašalinti židinį ir parinkti tinkamą stebėjimo ir gydymo taktiką. Kolposkopinis tyrimas atliekamas moteriai sėdint ginekologinėje kėdėje.
· Kolposkopijos kokybė priklauso nuo kolposkopuotojo įgūdžių, kvalifikacijos, įrangos ir vadybos.
· Kolposkopija leidžia nustatyti ikivėžines gimdos kaklelio, makšties ir vulvos pažaidas ir parinkti biopsijos vietą.
· Dėl mažo tyrimo specifiškumo kolposkopija neturėtų būti naudojama atliekant pirminę gimdos kaklelio vėžio patikrą. Ji turi būti skiriama tik toms moterims, kurioms nustatyta citologinių pokyčių.
· Kolposkopiją visada būtina atlikti prieš apsisprendžiant dėl gydymo.
· Kolposkopiją turėtų atlikti tik išmokyti kolposkopuotojai.
· Kolposkopinio tyrimo duomenys registruojami ligoninės informacinėje sistemoje.
· Rekomenduojama esant galimybei, kolposkopinio tyrimo vaizdus saugoti ir archyvuoti.
· Esant galimybei, turi būti atliekamas kolposkopinių vaizdų auditas.
· Kolposkopinio tyrimo etapai:
7.2. Kolposkopijos kokybės reikalavimai ir standartai
7.2.1. Organizaciniai reikalavimai
7.2.1.1. Kvietimas atlikti tyrimo ir laukimo laiko standartai
Pacientėms, kurioms reikalingas kolposkopinis tyrimas, siunčiamas laiškas, kuriame nurodomas paskirtas konsultacijos laikas ir gydymo įstaiga. Kartu su laišku pacientei siunčiama informacija apie tyrimą ir sutikimo forma, kurią pacientė į kliniką turi atsinešti pasirašytą priedą Nr. 12.
Prieš planuojamą vizitą nurodytos klinikos atstovas susisiekia su paciente ir patikslina jos galimybes atvykti į vizitą. Jei pacientė nurodytu laiku atvykti negali, jai pasiūlomas artimiausias galimas tyrimo vizitas ir sistemoje įrašoma neatvykimo priežastis.
SVARBU:
· Rekomenduojama, kad su laišku informaciją ir sutikimo formas gautų 95 proc. tikslinės grupės moterų.
· 100 proc. pakviestų moterų primenama apie vizitą telefono skambučiu.
Prieš kolposkopinį tyrimą kolposkopuotojas turi žinoti citologinio mėginio tyrimo rezultatą. Atsižvelgiant į citologinio mėginio tyrimo rezultatą ir citologinių pokyčių pobūdį, kolposkopinis tyrimas turi būti atliekamas per šį laiką nuo citologinio mėginio užregistravimo ESPBI IS GKV PP posistemėje:
· ne vėliau kaip per 2 savaites, jei įtariamas vėžys, naudojantis IPR sistema (IPR – išankstinės pacientų registracijos „žaliasis koridorius“);
· ne vėliau kaip per 4–8 savaites, jei citologiniu tyrimu nustatyta žymių pokyčių (HSIL);
· ne vėliau kaip per 12 savaičių, kai gaunami kitokie patologiniai citologinio mėginio rezultatai arba du ir daugiau CT yra netinkami vertinti.
Kolposkopijos metu atlikus biopsiją, tiriamoji medžiaga laikoma kambario temperatūroje ir turi patekti į laboratoriją per 3–5 darbo dienas.
SVARBU:
· Nurodytu laiko intervalu turi būti atliekama ne mažiau kaip 90 proc. visų kolposkopinių tyrimų.
7.2.1.2. Informavimo apie kolposkopijos rezultatus standartai
Jei atliekant kolposkopiją biopsinis mėginys neimamas, rekomendacijos ir tolesnis stebėjimo bei gydymo planas surašomas per tą pačią konsultaciją epikrizėje ir duodamas moteriai.
Jei pacientei kolposkopinio tyrimo metu paimamas biopsinis mėginys, gydytojas apie mėginio tyrimo rezultatus pacientę informuoja ne vėliau kaip 4 savaitės nuo biopsijos ir rekomenduoja:
3) atvykti pasiimti atsakymo į įstaigos registratūrą.
SVARBU:
· Per 4 savaičių laikotarpį nuo biopsijos dienos apie biopsinio mėginio tyrimo rezultatus turi būti informuojama daugiau kaip 90 proc. moterų.
· Per 8 savaičių laikotarpį nuo biopsijos dienos apie biopsinio mėginio tyrimo rezultatus turi būti informuojama 100 proc. moterų.
7.2.1.3. Neatvykusių atlikti tyrimo moterų pakartotinio informavimo standartai
Tyrimų duomenimis, iki 15 proc. moterų atlikti kolposkopinio tyrimo neatvyksta (bijo tyrimo, pamiršta, neatvyksta dėl menstruacijų, dėl to, kad dirba arba prižiūri vaikus, netinka laikas arba neturi transporto).
Moteriai neatvykus, su ja telefonu susisiekia gydytojo kolposkopuotojo asistentas, išsiaiškina neatvykimo priežastį, ją įrašo į ESPBI IS GKV PP posistemę, esant galimybei suderina kito kolposkopinio tyrimo vizito datą.
7.3. Patalpoms ir įrangai taikomi reikalavimai
7.3.1. Registratūra, tyrimo patalpa
Atvykusios atlikti tyrimo pacientės užregistruojamos ir vizito laukia laukiamojoje patalpoje. Rekomenduojama, kad kolposkopijos kabinetai turėtų atskirą įėjimą. Svarbu, kad patalpa būtų pritaikyta neįgalioms moterims.
Kolposkopijos patalpos reikalavimai:
· prioritetas – atskiri kolposkopijos centrai;
· kolposkopija gali būti atliekama ir kitose sveikatos priežiūros įstaigose mažesniuose kolposkopijos kabinetuose, kuriuose galima užtikrinti pacientės privatumą;
· ginekologinei apžiūrai tinkama kėdė, pageidautina, reguliuojamo aukščio ir padėčių;
· šviesos šaltinis, tinkamas gimdos kakleliui apšviesti;
· ginekologinė kėdė, transformuojama į kušetę;
· kolposkopijos centre ar ASPĮ kolposkopijos kabinete turi būti bent vienas su vaizdo kamera ir kompiuterine įranga sujungtas binokulinis kolposkopas, vaizdą didinantis nuo 3,5 iki 40 kartų ir turintis žalią filtrą;
· sterilūs ginekologiniai instrumentai ginekologiniam tyrimui atlikti;
· ginekologinei apžiūrai ir biopsijai reikalingi instrumentai;
· pirmosios pagalbos vaistinėlė;
· užrakinama dokumentų spinta.
Rekomenduojama turėti kompiuterinę įrangą, kurioje įdiegta kolposkopinių vaizdų saugojimo sistema. Esant galimybei, kompiuterinę įrangą reikėtų susieti su ligoninės informacine sistema.
7.4. Personalo kvalifikacijos reikalavimai
Kolposkopijos kabinete turi būti ne mažiau du darbuotojai: kolposkopuotojas ir asistentas (bendrosios praktikos slaugytoja(s) arba akušerė(-is)).
7.4.1. Tyrimą atliekančio gydytojo kvalifikacijos reikalavimai
Gydytojai, atliekantys kolposkopijos tyrimą, turi:
· turėti gydytojo akušerio-ginekologo kvalifikaciją patvirtinantį dokumentą;
· turėti LR galiojančią gydytojo akušerio-ginekologo licenciją;
· būti baigę podiplominius nekontaktinius 18 val. pažengusiųjų kolposkopijos kursus internetu ir kontaktinius 18 val. pažengusiųjų kolposkopijos kursus, turėti šių kursų baigimo sertifikatą;
· kartoti kolposkopijos kursus kas penkerius metus;
· pakartoti kursus per artimiausius metus, jei neatitinka reikalavimuose nustatytų kriterijų;
· siekdami išlaikyti kompetenciją ir aukštą kolposkopinio tyrimo kvalifikacinį standartą, per metus atlikti ne mažiau kaip 100 patologinių kolposkopinių tyrimų - įvertinti po daugiau nei 50 neryškių patologinių kolposkopinių pokyčių vaizdų ir daugiau nei 50 ryškių patologinių
kolposkopinių pokyčių vaizdų;
· per metus dalyvauti bent dviejuose DDK posėdžiuose;
· gebėti dirbti su vietinėmis ir nacionalinėmis sveikatos IT sistemomis.
7.4.2. Pagalbinio personalo kvalifikacijos reikalavimai
Kolposkopijos kabinete gydytojui padeda asistentas (bendrosios praktikos slaugytoja(s) arba akušerė (-is)), kuris turi:
· turėti kvalifikaciją patvirtinantį dokumentą;
· turėti LR galiojančią bendrosios praktikos slaugytojo ar akušerio licenciją;
· būti susipažinęs su kolposkopijos eiga, technika ir tyrimo reikalavimais;
· išmanyti medicininę terminologiją;
· gebėti dirbti su vietinėmis ir nacionalinėmis sveikatos IT sistemomis;
· būti baigęs pirmosios pagalbos kursus.
7.5. Duomenų registravimas, protokolai
7.5.1. Kolposkopinio tyrimo vertinimo protokolas
Kolposkopinis tyrimas vienai pacientei užtrunka ne mažiau kaip 30 min. Jei tyrime dalyvauja besimokantis kolposkopijos asmuo, apžiūra turi trukti ne mažiau kaip 40 min. Atvykdama atlikti tyrimo, moteris atsineša pasirašytą sutikimą.
Kolposkopinio tyrimo duomenys registruojami ligoninės informacinėje sistemoje. Jei tyrimo metu imamas biopsinis mėginys, kolposkopinio tyrimo radiniai įrašomi į siuntimo formą (Priedas Nr.2).
Kiekvieno tyrimo metu pildoma popierinė kolposkopinio tyrimo vertinimo forma ir elektroninis formos atitikmuo (Priedas Nr.2).
7.6. Kolposkopinio tyrimo kokybės vertinimas
7.6.1. Kolposkopinio tyrimo atlikimo standartai
Atsižvelgiant į pasiūlytus algoritmus, siekiant tinkamo ir adekvataus ikivėžinių gimdos kaklelio ligų gydymo, reikia atlikti kolposkopiją.
24 valandas prieš kolposkopinį tyrimą nepatartina:
· naudoti vaginalinių medikamentų, lubrikantų ir spermicidų;
· skalauti makštį;
· turėti vaginalinių lytinių santykių;
· imti mėginių iš gimdos kaklelio.
Turi būti matomas visas gimdos kaklelio plotas. Jeigu makšties šoninės sienelės kliudo matyti visą gimdos kaklelio plotą, būtina naudoti šoninius makšties skėtiklius. Prieš pradedant kolposkopinį tyrimą, jeigu reikia, gimdos kaklelį galima išvalyti fiziologiniu tirpalu, jo mechaniškai netraumuojant.
Siekiant pamatyti gimdos kaklelio nuokrypius nuo normos, reikia naudoti 3–5 proc. acto rūgšties tirpalą (poveikio laikas – 1 minutė).
Naudoti Liugolio tirpalą kolposkopiniam tyrimui patartina tada, kai acto rūgšties testas neduoda tikėtinų rezultatų.
7.6.1.1. Kolposkopinio tyrimo indikacijos
Kolposkopinis tyrimas atliekamas vadovaujantis nurodytais algoritmais (žiūrėti VIII skyrius. Taktika nustatyčius pokyčius).
Apibendrintos kolposkopinio tyrimo indikacijos:
· HSIL arba ASC-H citologiniai pokyčiai;
· nuolat aptinkami LSIL, ASCUS citologiniai pokyčiai;
· pirmą kartą diagnozuoti LSIL arba ASCUS citologiniai pokyčiai, kai kartu rastas AR ŽPV;
· AGC citologiniai pokyčiai;
· pasikartojantis (2 kartus iš eilės) patologinis citologinio mėginio tyrimo rezultatas moterims iki 34 metų arba patologinis bent vienas citologinio mėginio rezultatas ir rastas AR ŽPV;
· pasikartojantis (2 kartus iš eilės) patologinis citologinio mėginio tyrimo rezultatas moterims iki 34 metų, užsikrėtimas AR ŽPV nežinomas;
· aiškiai matomos plika akimi gimdos kaklelio, vulvos ir makšties gleivinės pažaidos;
· neaiškios kilmės kraujavimas iš lyties organų, kontaktinis kraujavimas.
7.6.1.2. Kolposkopinio tyrimo kontraindikacijos
· Absoliučių kontraindikacijų nėra
· Ūminis lytinių takų uždegimas
· Menstruacijos
7.6.1.3. Kolposkopinio tyrimo sukeliamos komplikacijos
Kolposkopinio tyrimo sukeliamos komplikacijos itin retos.
Kartais po tikslinės biopsijos gali kilti kraujavimas (dažniau pasitaiko nėščiosioms arba atlikus plačią eksciziją).
Ypač retai moteris gali nualpti.
7.6.1.4. Infomatyvus kolposkopinis tyrimas
Kolposkopinis tyrimas laikomas informatyviu, kai visame gimdos kaklelio plote matoma ir fiksuojama:
· bazinis plokščiasis epitelis, cilindrinis epitelis ir jungtis tarp jų (SCJ);
· gimdos kaklelio transformacijos zona;
· esami nuokrypiai nuo normos.
7. 6.2. Kolposkopinio tyrimo vertinimo standartai
7.6.2.1. Transformacijos zona
Gimdos kaklelio kanalas yra padengtas viensluoksniu liaukiniu epiteliu, sudarytu iš paprastų stulpinių ląstelių, išskiriančių gleives (lot. endocervix), ir makštinę gimdos kaklelio dalį dengiančio sluoksniuoto plokščiojo neragėjančio epitelio, atsparaus rūgščiai makšties terpei (lot. ectocervix). Atliekant gimdos kaklelio apžiūrą galima pastebėti, kad plokščiasis epitelis yra šviesiai rausvos spalvos, lygus ir dengia didžiąją dalį išorinio gimdos kaklelio paviršiaus. Liaukinis epitelis yra intensyvesnės raudonos spalvos. Išlindęs iš gimdos kaklelio kanalo, jis formuoja gimdos kaklelio ektopiją. Riba, kurioje susisiekia šie epitelio tipai, vadinama jungtimi. Su amžiumi stulpinės ląstelės palaipsniui virsta plokščiuoju epiteliu (šis procesas vadinamas metaplazija) ir dėl to jungtis kyla link gimdos kaklelio kanalo. Jungtis tarp plokščiojo ir stulpinio epitelių įvairiais gyvenimo tarpsniais kinta. Pavyzdžiui, jau intrauteriniu laikotarpiu viršutinės makšties dalies, besiformuojančios iš Miulerio latako, stulpinis epitelis virsta plokščiuoju; pokyčiai vyksta veikiant motinos estrogenui iki gimimo ir netrukus po gimimo, kintant makšties pH brendimo metu; pirmųjų mėnesinių ar pirmojo nėštumo metu stulpinis epitelis išsiverčia ir yra veikiamas makšties aplinkos; mažėjant hormonų aktyvumui perimenopauzės ir menopauzės laikotarpiais, jungtis kyla į gimdos kaklelio vidų.
Aktyvios metaplazijos vieta, kurioje stulpinis epitelis virsta plokščiuoju, vadinama transformacijos zona (TZ). Metaplazinės ląstelės geba fagocituoti svetimkūnius. Šios ląstelės fagocituoja virusus ir panaudoja jų DNR. Jei gimdos kaklelį pažeidžia didelės rizikos žmogaus papilomos virusas, metaplazijos procesas sutrinka ir vystosi intraepitelinė pažaida, kurios laiku neaptikus ir nepradėjus gydyti gali išsivystyti gimdos kaklelio vėžys.
7.6.2.2. Transformacijos zonos klasifikacija
Transformacijos zona skirstoma į tris tipus:
I tipas (A) – visa TZ yra gimdos kaklelio makštinėje dalyje, epitelių jungtis matoma gerai. Jei apima daugiau nei pusę ektocervikalinio epitelio, TZ laikoma didele;
II tipas (B) – TZ ar jos dalis yra gimdos kaklelio kanale, bet kolposkopuojant epitelių jungtis matoma;
III tipas (C) – visa ar dalis TZ yra kanale ir, nepaisant pastangų, kolposkopuojant epitelių jungtis nematoma arba matoma ne visa.
Galimas įgimtos gimdos kaklelio (kartais ir makšties) TZ variantas. Tokią TZ atpažinti neretai sunku, tačiau dažant actu ji dažniau yra blankios spalvos, nesidažo jodu. Nepatyręs kolposkopuotojas įgimtą TZ gali palaikyti nežymiais CIN ar VAIN pokyčiais.
Jei epitelių jungties nematyti (TZ yra gimdos kaklelio kanale), į endocervikalinio kanalo apatinę dalį reikia įkišti endocervikalinį plėtiklį. Jei matoma visa transformacijos zona, kolposkopinis tyrimas vertinamas kaip tinkamas. Jei TZ nematyti net naudojant endocervikalinį plėtiklį, kolposkopinis tyrimas vertinamas kaip neinformatyvus.
Naudojant ekscizinę gydymo techniką, metodą reikia modifikuoti pagal TZ tipą, keičiant kilpos formą, dydį ir įsiskverbimo gylį.
7.6.2.3. Kolposkopijos atlikimo technika
Tyrimas atliekamas moteriai gulint ginekologinėje kėdėje.
Pirmiausia apžiūrima vulva, tik tada į makštį kišami pasirinkto dydžio skėtikliai (patogiau – suveriamieji). Siekiant pašalinti gleives, kraują ar makšties išskyras, gimdos kaklelį galima praplauti fiziologiniu tirpalu, švelniai išvalyti vata (tokiu atveju galimas mechaninis epitelio pažeidimas). Gimdos kaklelis apžiūrimas optine sistema padidinus vaizdą iki mažiausio įmanomo lygio, kad būtų apžiūrimas kuo didesnis bendras plotas. Siekiant įvertinti kapiliarinę gimdos kaklelio struktūrą, rekomenduojama naudoti žalią filtrą.
Vertinant ir žymint pokyčius, gimdos kaklelis padalijamas į keturis kvadrantus. Vertinami ir aprašomi kiekvieno kvadranto pokyčiai. Kvadrantai numeruojami pradedant nuo pirmo (tarp 12–15 val.) ir einama pagal laikrodžio rodyklę žemyn.
Identifikuojama plokščiojo ir stulpinio epitelių jungtis, transformacijos zona visuose kvadrantuose, nustatomas transformacijos zonos tipas (I, II ar III).
Ant gimdos kaklelio užpilama 3 proc. arba 5 proc. acto rūgšties tirpalo. Praėjus ne mažiau kaip 20 sekundžių vertinamas actu aplietos vietos baltumo laipsnis. Acto rūgštis sukelia audinių edemą, paviršinį tarpląstelinių baltymų krešėjimą ir taip sumažina epitelio skaidrumą. Poepiteliniai kapiliarai tampa mažiau matomi, o pats epitelis atrodo baltas. Vertinamas pabalimo greitis, intensyvumas ir baltos spalvos išnykimo greitis.
Acto baltumo spalva epitelis gali nusidažyti šiais atvejais:
· nesubrendusi plokščioji metaplazija;
· gyjantis ar regeneruojantis epitelis;
· įgimta transformacijos zona;
· žmogaus papilomos viruso infekcija;
· gimdos kaklelio intraepitelinė neoplazija (CIN);
· CIN, kai rastas ŽPV;
· liaukinė intraepitelinė neoplazija;
· invazinė plokščiųjų ląstelių karcinoma;
· adenokarcinoma.
Atliekamas Šilerio mėginio tyrimas (Schillerio testas). Tai kolposkopinis vandeniniu jodo (Liugolio jodas) tirpalu suvilgyto gimdos kaklelio vertinimas. Liugolio jodas nudažo normalų plokščiąjį epitelį vienalyte tamsiai ruda spalva. Šilerio mėginio tyrimo rezultatas laikomas teigiamu, kai jodu dažoma sritis nenusidažo.
Normaliame plokščiajame epitelyje gausu glikogeno, kurį jodas nudažo rudai, o ikivėžinėse ląstelėse glikogeno nėra, todėl jos nenusidažo.
Reikia turėti omenyje, kad ne visas epitelis, kuriame nėra glikogeno, yra patologinis. Jodu nesidažo nesubrendusi plokščioji metaplazija, gyjantis ar regeneruojantis epitelis, įgimta transformacijos zona ir normalus epitelis, paveiktas ŽPV.
Kontroliuojant kolposkopu, galima paimti tikslinį gimdos kaklelio biopsinį mėginį iš pakitusių gimdos kaklelio ar makšties plotų. Tam naudojamos biopsinės žnyplės.
7.6.2.4. Kolposkopinio tyrimo vertinimas
Kolposkopuojant vertinamos kaklelio epitelio pokyčių ribos, paviršiaus ypatumai (kolposkopinių vaizdų kategorijomis), spalva, kraujagyslių ypatumai.
Kolposkopinio tyrimo radiniai, dėl kurių galima įtarti su CIN susijusius pokyčius:
· švelni ar ryški punktacija;
· švelni ar ryški mozaika;
· netipinės kraujagyslės (įtariamas vėžys);
· švelnūs ar ryškūs balti acto sukelti pokyčiai;
· pažaidos kraštai: esant žemo laipsnio displazijai, pažaidos kraštai yra neryškūs arba neaiškių ribų, aukšto laipsnio – aštrūs, tiesūs.
Siekiant suvienodinti kolposkopijos vertinimo standartus, siūloma naudoti Swede skalę.
7.6.2.1 lentelė. Swede skalė
|
|
0 |
1 |
2 |
Iš viso |
| Acto poveikis |
Actas nenudažo, epitelis skaidrus |
Actas nudažo švelniai (švelni pieno spalva) |
Ryškus, aiškiai matomas baltas plotas |
|
| Kraštai, paviršius |
Difuzinis, išsiliejęs |
Aštrūs, nelygūs, netaisyklingi kraštai, „geografiniai satelitai“ |
Aštrūs, lygūs kraštai, aiškiai matomas skirtumas tarp paviršių |
|
| Kraujagyslės |
Taisyklingos |
Nėra |
Atipinės |
|
| Pažaidos dydis |
< 5 mm |
5–15 mm arba du kvadrantai |
> 15 mm arba 3–4 kvadrantai, neaiškios ribos kanale |
|
| Jodo poveikis |
Nusidažo rudai |
Silpnai gelsva spalva |
Ryškiai geltonas plotas |
|
Vertinimas pagal skalę:
0–4 balai – normalūs arba nežymūs pokyčiai;
5–6 balai – žymūs pokyčiai;
7–10 balų – žymūs pokyčiai, įtariamas invazinis vėžys.
7.6.2.5. Kolposkopinių vaizdų analizė
Atliekant kolposkopinį tyrimą, pirmiausia vertinama:
· kolposkopinio tyrimo informatyvumas (informatyvus ar neinformatyvus);
· požymiai, rodantys uždegimą, kraujavimas prilietus gimdos kaklelį, galimi randai;
· epitelių jungtis (matoma gerai, matoma iš dalies ar nematoma);
· TZ tipas (1, 2 ar 3).
Jei įtariama patologija, vertinama:
· pažaidos lokalizacija (kiek ploto matoma, kiek nueina į kanalą);
· pažaidos dydis (kiek kvadrantų dengia).
7.6.2.5.1 lentelė. Transformacijos zonos geografinė klasifikacija (Prendiville, 2003b)
| Transformacijos zonos tipas |
TZ dydis |
TZ lokalizacija |
TZ matomumas |
Kolposkopijos informatyvumas |
| 1 tipas |
Maža |
Visa makštinėje gimdos kaklelio dalyje (ectocervix) |
Visiškai matoma |
Informatyvi |
| 1 tipas |
Didelė |
Visa makštinėje gimdos kaklelio dalyje (ectocervix) |
Visiškai matoma |
Informatyvi |
| 2 tipas |
Maža |
Dalinai gimdos kaklelio kanale (endocervix) |
Visiškai matoma |
Informatyvi |
| 2 tipas |
Didelė |
Dalinai gimdos kaklelio kanale (endocervix) |
Visiškai matoma |
Informatyvi |
| 3 tipas |
– |
Visa gimdos kaklelio kanale |
Nėra visiškai matoma |
Neinformatyvi |
| 3 tipas |
Maža |
Dalinai gimdos kaklelio kanale |
Nėra visiškai matoma |
Neinformatyvi |
| 3 tipas |
Didelė |
Dalinai gimdos kaklelio kanale |
Nėra visiškai matoma |
Neinformatyvi |
Kolposkopiniams vaizdams vertinti naudojama IFCPC patvirtinta klasifikacija (* nurodo ryškius pokyčius):
I. Normalūs kolposkopiniai vaizdai:
· originalus plokščiasis epitelis, brandus plokščiasis epitelis;
· stulpinis epitelis (ektopija);
· TZ, metaplastinis epitelis, Ovula Nabothi, atviros liaukos.
II. Nenormalūs kolposkopiniai vaizdai:
· švelniai baltai nuo acto nusidažantis epitelis;
· ryškiai baltai nuo acto nusidažantis epitelis*;
· švelni mozaika;
· ryški mozaika*;
· švelni punktacija;
· ryški punktacija*;
· neryškus jodu nenusidažantis plotas;
· ryškus jodu nenusidažantis plotas*;
· netipinės kraujagyslės*.
IV. Neinformatyvus kolposkopinis tyrimas:
· nematyti epitelių jungties;
· ryškus uždegimas, ryški atrofija, trauma;
· nematyti gimdos kaklelio.
V. Įvairūs radiniai:
· kondiloma;
· keratozė;
· erozija;
· uždegimas;
· atrofija;
· deciduozė;
· polipai.
7.6.2.5.1. Gimdos kaklelio kolposkopija po menopauzės
Moterų, po menopauzės nenaudojančių pakaitinės estrogenų terapijos, gimdos kaklelio epitelis yra atrofinis. Gimdos kaklelio ir makšties epitelis tampa labai plonas, todėl aiškiai matomi poepiteliniai kapiliarai gali atrodyti raudoni ir netipiniai, o acto rūgšties testas ne visada efektyvus. Jei yra kokių nors sunkumų vertinant gimdos kaklelį po menopauzės, naudinga skirti trumpą (3–4 savaičių) intravaginalinio kremo ar žvakučių su estrogenais kursą.
7.6.2.5.2. Kolposkopija nėštumo metu ir po gimdymo
Kolposkopija nėštumo metu atliekama, jei gaunami patologiniai citologinio mėginio tyrimo rezultatai. Kolposkopija atliekama ir vertinama pagal tuos pačius standartus kaip ir nenėščiai moteriai. Kolposkopiją nėščioms moterims turi atlikti tik patyręs kolposkopuotojas. Dėl anatominių nėščios moters ypatumų siūloma naudoti didelių matmenų skėtiklį.
Nėščių moterų gimdos kaklelis yra didesnis, edemiškas, su išryškėjusiomis kraujagyslėmis. Gimdos kaklelį paprastai dengia storas sluoksnis gleivių, kurias sunku pašalinti, pirmą kartą besilaukiančioms moterims gali būti būdinga nesubrendusi metaplazija.
Nėštumo metu imant biopsinius mėginius dažniau pasireiškia gausesnis kraujavimas, o mėginiai ne visada tinkami vertinti histologiškai. Nėščių moterų biopsija ir ikivėžinių pokyčių gydymas turėtų būti atidedami, kol moteris pagimdys, išskyrus klinikines situacijas, kai įtariamas invazinis vėžys.
Jei nėščioms moterims reikia pakartotinės kolposkopijos dėl nežymių pokyčių, tyrimą rekomenduojama atidėti po gimdymo. Jei nėščioms moterims reikia pakartotinės kolposkopijos dėl žymių pokyčių, tyrimą rekomenduojama atlikti antro nėštumo trimestro pabaigoje ir po gimdymo, įtariant aukšto laipsnio displaziją – antro nėštumo trimestro pabaigoje.
Jei kolposkopuotojas įtaria invazinius pokyčius, biopsiją rekomenduojama atlikti pasirenkant visų matomų plotų pašalinimo taktiką. Jei įtarimo dėl invazinio vėžio nėra, biopsiją reikėtų atlikti praėjus ne mažiau kaip 6 savaitėms po gimdymo, geriausiai 3 mėnesiai po gimdymo. Maitinančios krūtimi, menstruacijų po gimdymo nepatiriančios moters gimdos kaklelis gali atrodyti atrofiškas, todėl, jei kolposkopinis tyrimas būtinas, galima skirti trumpą estrogeno kremo, tablečių ar ovulių, įterpiamų į makštį, kursą. Arba galima laukti, kol estrogenizacija grįš savaime.
7.6.3. Pagalbiniai kolposkopinio tyrimo instrumentai ir priemonės
7.6.3.1. Kolposkopui taikomi reikalavimai
Kolposkopijos centre ar SPĮ kolposkopijos kabinete turi būti bent vienas su vaizdine kamera ir kompiuterine įranga sujungtas binokulinis kolposkopas, vaizdą didinantis nuo 3,5 iki 40 kartų ir turintis žalią filtrą.
7.6.3.2. Papildomi instrumentai ir priemonės
Siekiant tinkamai atlikti kolposkopiją, reikalingos šios priemonės ir instrumentai:
· sterilios pirštinės;
· įvairaus dydžio skėtikliai, plėtikliai (pageidautina – su dūmų ištraukimo jungtimi), šoninis makšties plėtiklis;
· kiuretė gimdos kaklelio kanalo kiuretažui;
· endocervikalinis šepetėlis;
· viendantės žnyplės;
· biopsinės žnyplės;
· NaCl 0,9 proc. tirpalas;
· acto rūgšties tirpalas (3 proc. arba 5 proc.);
· liugolio tirpalas (vandeninis jodo tirpalas);
· vatos tamponėliai;
· gimdos kaklelio kanalo plėtiklis;
· adatos laikiklis;
· 2-0 besirezorbuojantis siūlas;
· 5 ml švirkštas su adata;
· vietinis anestetikas (1 ar 2 proc. lidokainas);
· adrenalino tirpalas 1:100000.
7.6.4. Atliktų tyrimų mėginių saugojimas ir ištyrimas
Visi mėginiai dedami į tam skirtą talpyklą (indelį), užpilami 10 proc. buferiniu formalino tirpalu, kurio tūris 10 kartų didesnis už mėginio tūrį. Kolposkopijos metu atlikus biopsiją, tiriamoji medžiaga laikoma kambario temperatūroje ir turi patekti į laboratoriją per 3–5 darbo dienas. Jei mėginys tirti siunčiamas skubiai, audinio gabalėlis gali būti dedamas į talpyklą ir neužpilamas jokiu tirpalu.
Duomenys indelio etiketėje ir siuntime turi sutapti.
Siuntime nurodoma:
· pacientės identifikaciniai duomenys;
· pacientės sutikimas dėl tyrimo;
· laboratorijos, kuriai siunčiamas mėginys, pavadinimas ir adresas;
· laboratorijos identifikacinis numeris
· siunčiančio gydytojo vardas, pavardė ir parašas;
· mėginio paėmimo data;
· mėginio ėmimo tipas;
· kolposkopinio tyrimo duomenys;
· tikslios biopsijos vietos, anatominė biopsijos vieta;
· indelių skaičius, audinio gabaliukų skaičius;
· svarbi klinikinė informacija.
Siuntimo formos (Priedas Nr. 2) ir (arba) jų elektroniniai atitikmenys bei histologinio tyrimo atsakymo duomenys (popieriniai ar kompiuterinėje programoje) saugomi 25 metus.
7.6.5. Kolposkopinio tyrimo auditas
Kolposkopinio tyrimo jautrumas ir specifiškumas nėra dideli: jautrumas 57–96 proc., specifiškumas – 48 proc.
Kolposkopija laikoma neinformatyvia, kai diagnozė nepatvirtinama histologiškai. Kolposkopijos neinformatyvumą gali lemti liaukinės pažaidos ar kanale esanti epitelių jungtis.
Kolposkopinių tyrimų auditas turi būti vykdomas ne mažiau 4 kartus per metus, atliekant atvejų kolposkopinių vaizdų ir histologinių rezultatų palyginimą. Auditas atliekamas vadovaujant kolposkopijos lyderiui.
Per aptarimus:
· vertinama paslaugos kokybė – kiek pacienčių tyrimą gavo laiku, kiek užtruko tyrimas ir koks yra laikas iki ištyrimo ir gydymo;
· vertinami neaiškūs atvejai, neatitiktys tarp CT, kolposkopijos ir histologinio tyrimų rezultatų;
· vertinama, ar visi atvejai aprašyti ir pasirašyti tinkamai;
· esant nesutapimui tarp kolposkopinio vaizdo ir histologinio rezultato, privaloma neatitikimo peržiūra, kartu pagal galimybę vertinant vaizdų analizę.
7.6.6. Atliktų tyrimų rezultatų valdymas
Apie kolposkopinio tyrimo metu paimto biopsinio mėginio tyrimo rezultatą moteris turi būti informuojama gydytojo ne vėliau kaip per 4 savaites nuo biopsijos dienos.
Jei pacientei reikalingas nuodugnesnis pažeistų plotų gydymas ar operacija, vadovaujamasi LR sveikatos apsaugos ministro nustatyta onkologinių ligų diagnostikos ir gydymo paslaugų prieinamumo ir kokybės rodiklių ir jų stebėsenos tvarka:
· patvirtinus vėžio diagnozę, tyrimų planas sudaromas ir įvykdomas per 14–28 dienas nuo biopsinio mėginio tyrimo rezultato užregistravimo ESPBI IS GKV PP posistemėje, gydymas stacionare pradedamas per 4–8 savaites;
· jei atliekant histologinio mėginio tyrimą patvirtinami žymūs pokyčiai, gydymas pradedamas ne vėliau kaip per 12 savaičių.
7.6.7. Tikslinė gimdos kaklelio biopsija
Gimdos kaklelio biopsija atliekama biopsinėmis žnyplėmis, kontroliuojant kolposkopu, imant mėginį iš labiausiai pažeistų vietų.
· Imami ne mažiau kaip 2 biopsiniai mėginiai iš skirtingų labiausiai pakitusių vietų.
· Jei citologiniu tyrimu randama žymių pokyčių, o atliekant kolposkopinį tyrimą pokyčiai neryškūs, moteriai atliekamos dauginės biopsijos.
· Biopsinio mėginio audinyje turi būti ir paviršinio epitelio, ir stromos, kad būtų galima vertinti, ar pažaida yra tik intraepitelinė, ar tęsiasi iki stromos.
· Jei biopsinis mėginys imamas su elektros kilpa, reikia vengti termokoaguliacijos požymių.
· Prireikus, kai atliekama didesnio ploto biopsija su elektros kilpa, gali būti naudojamas vietinis anestetikas.
· Jei po biopsijos atsiranda kraujavimas, jį galima sustabdyti taikant diatermiją, jei kitos kraujavimo stabdymo priemonės yra neefektyvios.
Biopsinio mėginio tyrimo rezultatai užregistruojami ESPBĮ IS GKV PP posistemėje.
Rezultatų ataskaitos perduodamos tinkamai užsakymą pateikusiam gydytojui ar klinikai. Laboratorija užtikrina, kad būtų įdiegtas tinkamas ataskaitų pateikimo mechanizmas.
Moteris apie biopsijos mėginio rezultatus informuojama ne vėliau kaip per 4 savaites nuo biopsijos dienos.
7.6.8. Endocervikalinis kiuretažas
Endocervikalinio kiuretažo tikslas – aptikti endocervikalinę (esančią gimdos kaklelio kanale) pažaidą, kurios neįmanoma pasiekti atliekant kolposkopinę biopsiją.
Jei histologiniam tyrimui atlikti reikalinga endocervikalinė medžiaga, kolposkopuotojas paima mėginį naudodamas endocervikalinę kiuretę arba endocervikalinį šepetėlį.
Endocervikalinis kiuretažas neturėtų būti atliekamas nėščiai moteriai.
Privalomi reikalavimai ir standartai:
1) teigiama prognostinė vertė. Kolposkopiniu ir histologiniu tyrimais nustatyti žymūs pokyčiai turi sutapti > 65 proc. atvejų;
2) jei yra atipinė TZ, biopsija atliekama > 90 proc. atvejų; biopsiniai mėginiai turi būti tinkami histologiniam tyrimui > 95 proc. atvejų; 90 proc. moterų, kurioms reikalingas gydymas po biopsijos, turi būti gydomos ambulatoriškai, taikant vietinę anesteziją;
Kolposkopija
Radus citologinių gimdos kaklelio pokyčių, priklausomai nuo jų pobūdžio, atliekama kolposkopija.
Kolposkopija – tai instrumentinis tyrimas vulvos, makšties ir gimdos kaklelio pokyčiams įvertinti binokuliniu optiniu prietaisu (mikroskopu) vaizdą padidinus nuo 3,5 iki 40 kartų. Kolposkopinis tyrimas atliekamas moteriai sėdint ginekologinėje kėdėje.
Kolposkopija yra saugi ir neskausminga procedūra, kurios trukmė – nuo 10 iki 30 min. Tyrimą atlieka kvalifikuotas gydytojas kolposkopuotojas, turintis akušerio-ginekologo licenciją.
Kolposkopijos tikslas – rasti citologiniu tyrimu nustatytų atipinių ląstelių vietas ir įvertinti pažeistą gimdos kaklelio, makšties ar vulvos paviršiaus plotą. Kolposkopinio tyrimo metu iš pakitusių plotų galima paimti mažų audinio gabalėlių tyrimui, t. y. atlikti taškinę biopsiją. Biopsinės medžiagos histologiniu tyrimu patvirtinami arba paneigiami ikivėžiniai pokyčiai ir gimdos kaklelio vėžio diagnozė. Siekiant tiksliau diagnozuoti pakitusius epitelio pokyčius, tyrimo metu naudojami 3 proc. acto rūgšties tirpalas ir vandeninis jodo tirpalas.
Įrodyta, kad biopsija yra saugi ir tiksli diagnostinė procedūra. Kolposkopija padeda tiksliau surasti ir įvertinti vulvos, makšties ir gimdos kaklelio epitelių pokyčių laipsnį, išplitimą, nustatyti tinkamiausią biopsijos vietą, radikaliai pašalinti židinį ir parinkti tinkamą stebėjimo ir gydymo taktiką.
Kolposkopinio tyrimo komplikacijų būna itin retai. Kartais po tikslinės biopsijos gali kilti kraujavimas, bet jis sustabdomas to paties tyrimo metu. Kraujavimas dažnesnis, jei tyrimo metu atliekamas platus pažeistų plotų išpjovimas.
Absoliučių kolposkopijos kontraindikacijų nėra. Kolposkopijos kontraindikacijos:
· ūmus lytinių takų uždegimas;
· menstruacijos (tyrimas gali būti atliekamas bet kurią kitą ciklo dieną).
24 valandas prieš kolposkopinį tyrimą nepatartina:
· naudoti vaginalinių medikamentų, lubrikantų, kremų, spermicidų ir kt.;
· skalauti makštį;
· turėti vaginalinių lytinių santykių;
· imti mėginių iš gimdos kaklelio.
Pacientė turi informuoti gydytoją, jei:
· vartojate bet kokius kraują skystinančius vaistus (aspiriną, varfariną, hepariną, klopidogrelį ir kt.);
· esate nėščia ar galvojate, kad galėjote pastoti. Kolposkopinį tyrimą atlikti nėštumo metu galima ir tai yra saugu, tačiau ši žinia padės gydytojui apsispręsti dėl biopsijos būtinybės nėštumo metu.
Jei Jums buvo atlikta biopsija:
· po tyrimo kelias dienas galite pastebėti negausių kraujingų išskyrų, bet jos per kelias dienas išnyks;
· jei atliekant tyrimą naudotas vandeninis jodo tirpalas, išskyros gali būti tamsiai rudos, tamsaus šokolado ar kavos tirščių spalvos;
· galite jausti nedidelį maudimą ar skausmą pilvo apatinėje dalyje – jis praeis per kelias valandas po tyrimo;
· 48 val. po tyrimo į makštį nekiškite tamponų, venkite lytinių santykių, nenaudokite jokių vaginalinių medikamentų, kremų ir kt.;
· visada paklauskite gydytojo, kada ir kaip sužinosite tyrimo atsakymą.
Nedelsdama kreipkitės į gydytoją, jei:
· po tyrimo gausiai kraujuojate;
· kraujavimas užsitęsia ilgiau nei 7 dienas;
· išskyros iš makšties tampa nemalonaus kvapo;
· išlieka pilvo skausmai, nepaisant vaistų nuo skausmo vartojimo;
· pakyla ir laikosi ≥ 38 °C kūno temperatūra.
![]()
VIII SKYRIUS. TAKTIKA NUSTAČIUS POKYČIŲ
8.1. Gimdos kaklelio vėžio patikros programos valdymo taktika nustačius patologiją
8.1.1. Terminai ir siuntimo standartai aptikus vėžį
Labai svarbu, kad invazinė liga neliktų nepastebėta. Rekomenduojama ekscizija (> 95 proc.) šiais atvejais:
· kai didžiojoje dalyje ektocerviko yra aukšto laipsnio pokyčių;
· kai atliekant kolposkopiją pastebimi nežymūs pokyčiai, bet citologiniu tyrimu nustatoma aukšto laipsnio pokyčių;
· kai citologiškai įtariama invazinė liga ar liaukinė neoplazija ir pažaida prasiskverbusi į endocervikalinį kanalą, reikia išpjauti pakankamai gimdos kaklelio kanalo audinių, kad būtų pašalinta visa endocervikalinė pažaida;
· pirmiau nurodytose situacijose tikslinės taškinės biopsijos nėra laikomos patikimai informatyviomis.
Kartais gali būti svarbių priežasčių, dėl kurių ekscizija neatliekama (pvz., nėštumas). Priežastys, kodėl neatlikta biopsija, visada užfiksuojamos.
8.1.2. Citologinių tyrimų aprašų prieinamumas
Prieš kolposkopinį tyrimą kolposkopuotojas turi turėti galimybę susipažinti su moters patikros tyrimo aprašu.
8.1.3. Netinkami mėginiai
Jei pradinis patikros mėginys yra netinkamas, pakartotinis mėginys turėtų būti imamas praėjus ne mažiau kaip 3 mėnesiams nuo pirmojo mėginio ėmimo. Gimdos kaklelio patikros mėginių ėmimas neturėtų būti kartojamas pirmosios kolposkopijos metu, kai moteris atvyksta konsultacijai po netinkamo citologinio mėginio tyrimo aptikus didelės rizikos žmogaus papilomos virusą (AR ŽPV), jeigu po tyrimo praėjo mažiau nei 3 mėn.
Pacientės, kurių du iš eilės mėginiai yra netinkami, siunčiamos atlikti kolposkopijos. Jei kolposkopiniu tyrimu pokyčių neaptinkama ir kolposkopinis tyrimas buvo tinkamas, šios moterys pakartotinai tiriamos po 12 mėnesių.
Jei po 12 mėnesių patikros tyrimas (ŽPV ar PAP) neigiamas, moteris toliau kviečiama dalyvauti patikros programoje įprasta tvarka. Jei citologiniais tyrimais aptinkama pokyčių, elgiamasi taip, kaip nustatyta nacionaliniuose protokoluose.
Jei po 12 mėnesių AR ŽPV persistuoja, moteris siunčiama konsultuotis pas ginekologą (atlikti kolposkopijos).
8.1.4. Neigiami rezultatai
Tinkami tyrimui mėginiai, kuriuose nėra atipinių ląstelių ar neaptinkama AR ŽPV, klasifikuojami kaip neigiami. Moterims, gavusioms pranešimą apie neigiamą patikros rezultatą, gali būti saugiai taikoma įprasta patikros programos eiga.
25–34 m. (imtinai) amžiaus moterys:
Įprastiniu citologiniu tyrimu aptikus ASC-US ar AGC, numatyti tolesnę taktiką geriausiai padeda AR ŽPV tyrimas.
Nesant galimybių atlikti ŽPV tyrimą (arba kai AR ŽPV tyrimas yra neinformatyvus) moteriai kartojamas įprastinis citologinis tyrimas po 3–6 mėn. PSP grandyje. Pakartotinai aptikus citologinių pokyčių, moteris siunčiama atlikti kolposkopijos. Kolposkopija turi būti atlikta per 12 savaičių.
Esant galimybei atlikti ŽPV tyrimą, moterys, kurioms aptinkama AR ŽPV, turi būti siunčiamos atlikti kolposkopijos. Moterims, kurioms AR ŽPV neaptinkama, toliau kviečiamos dalyvauti patikros programoje įprasta tvarka.
35–59 m. (imtinai) amžiaus moterys
Esant nustatytam teigiamam ŽPV tyrimo rezultatui ir citologiniu tyrimu aptikus ASC-US, moteriai iškart skiriama kolposkopija. Kolposkopija turi būti atlikta per 12 savaičių.
8.1.6. Nežymūs plokščialąsteliniai intraepiteliniai pokyčiai (žemo laipsnio pokyčiai) (LSIL)
Aptikus LSIL, moteris siunčiama atlikti kolposkopijos, konsultuotis su ginekologu ir atlikti kolposkopijos. Kolposkopiniu tyrimu jokių pokyčių neaptikus, rekomenduojama kartoti patikros tyrimus (citologinį ar AR ŽPV tyrimą) po 1 metų.
AR ŽPV tyrimas padeda numatyti tolesnę taktiką. Esant galimybei jį atlikti, moterims, kurioms AR ŽPV neaptinkama, kviečiamos dalyvauti patikros programoje įprasta tvarka.
Kolposkopija turi būti atlikta per 12 sav.; priimtinas lygis ≥ 90 proc.
8.1.7. Žymūs plokščialąsteliniai intraepiteliniai pokyčiai (aukšto laipsnio pokyčiai) (HSIL, ASC-H)
Aptikus aukšto laipsnio pokyčių (HSIL, ASC-H), moteris visada siunčiama atlikti kolposkopijos. konsultuotis su ginekologu ir atlikti kolposkopijos.
Kolposkopija turi būti atlikta per 4–8 savaites; priimtinas lygis ≥ 90 proc.
· Moterų, kurioms nustatyta žymių citologinių pokyčių, bet per kolposkopiją pokyčių visiškai matomoje TZ nepastebėta, įskaitant makšties apžiūrą, patikros rezultatą citopatologas turėtų aptarti DDK posėdyje. Žymius citologinius pokyčius patvirtinus, turi būti taikomas ekscizinis gydymas.
· Moterims, kurioms nustatyta žymių citologinių pokyčių, o per kolposkopiją jungtis matoma, bet ne visa (TZ 3 tipas), turi būti taikomas ekscizinis gydymas.
· Moterys, kurioms nustatyta aukšto laipsnio citologinių pokyčių, o biopsija patvirtina nežymius pokyčius LSIL (CIN1), priklausomai nuo moters amžiaus ir kitų rizikos veiksnių, gali būti stebimos arba joms gali būti rekomenduojama ekscizinė procedūra. Gydyti būtina, jeigu pakartojus tyrimą po 12 mėnesių aptinkama citologinių pokyčių arba išlieka infekuotumas AR ŽPV.
8.1.8. Invazinė plokščiųjų ląstelių karcinoma
Citologiškai įtariant invazinę plokščiųjų ląstelių karcinomą, moterys turi būti siunčiamos pas ginekologą (atlikti kolposkopijos) iškart.
Kolposkopija turi būti atlikta per 2 savaites.
8.1.9. Liaukinė neoplazija
Citologiškai aptikus liaukinę neoplaziją, moterys turi būti siunčiamos atlikti kolposkopijos iškart. Kolposkopija turi būti atlikta per 4–8 savaites; priimtinas lygis ≥ 93,0 proc.
Tikslinės biopsijos, atliekamos kontroliuojant kolposkopu, jautrumas diagnozuojant intraepitelines liaukų pažaidas yra mažas. Be to, ji nepadeda tiksliai nustatyti diagnozės, nes negali atmesti invazinės ligos. Patikimai diagnozuoti žymius liaukinius pokyčius ir atskirti juos nuo invazinės adenokarcinomos galima tik histopatologiškai, atlikus ekscizinę biopsiją, apimančią ir gimdos kaklelio kanalo gleivinę.
Ekscizijos dydis turi būti individualus, priklausomai nuo moters amžiaus.
Jaunesnėms moterims arba norinčioms išsaugoti vaisingumą moterims, kurių epitelių jungtis (SCJ) matoma per kolposkopiją, rekomenduojama cilindro formos gimdos kaklelio ekscizinė biopsija, apimanti visą transformacijos zoną (TZ) ir mažiausiai 1 cm gimdos kaklelio kanalo virš epitelių jungties.
Vyresnio amžiaus moterims arba kai epitelių jungties per kolposkopiją nematyti, reikia atlikti ECC arba cilindrinę ekscizinę biopsiją, apimančią visą matomą TZ ir 20–25 mm endocervikalinio kanalo. Kad būtų galima geriau įvertinti ekscizijos ribas, reiktų stengtis naudojamo ekscizinio metodo terminį poveikį audiniams sumažinti iki minimumo.
Moterims, kurių liaukinio epitelio pokyčiai, nustatyti citologiniu tyrimu, būdingi endometriumo ląstelių pokyčiams, kai moteris yra vyresnė nei 35 m. amžiaus arba jaunesnė nei 35 m. amžiaus ir pasireiškia nenormalus kraujavimas iš makšties, reikia atlikti ir endometriumo biopsiją.
Endocervikalinio kiuretažo vaidmuo nustatant endocervikalinio tipo liaukinę neoplaziją nėra visiškai aiškus, todėl jis nėra rutiniškai rekomenduojamas.
8.1.10. Neaiškūs atvejai
Aptikus nenormalių sunkiai vertinamų gimdos kaklelio citologinių pokyčių pacientę reikia siųsti atlikti kolposkopinio tyrimo. Tokiais atvejais kolposkopiniai vaizdai taip pat gali būti nespecifiniai, tačiau tikslesnį vertinimą greičiausiai bus galima gauti derinant citologinio, kolposkopinio ir histologinio tyrimų rezultatus. Idealiu atveju prieš nusprendžiant dėl tolesnės taktikos tokius atvejus turėtų išnagrinėti citologas, histopatologas ir kolposkopuotojas kolposkopijos daugiadalykiame konsiliume.
8.1.11. Gerybinės endometriumo ląstelės gimdos kaklelio citologinio tyrimo mėginiuose
Gerybinės endometriumo ląstelės nurodomos tik 45 metų ir vyresnių moterų mėginiuose, kurių ŽPV tyrimo rezultatai teigiami. Programos rekomendacijos grindžiamos tik gimdos kaklelio ląstelių pokyčiais. Jei gimdos kaklelio ląstelių pokyčių nepastebima, mėginio rezultatas vertinamas kaip neigiamas, moteris toliau kviečiama dalyvauti programoje įprasta tvarka.
8.1.12. Patologiškai pakitęs kaklelis
Jei patikros mėginio ėmimo metu apžiūrint gimdos kaklelį įtariamas gimdos kaklelio vėžys, paėmus mėginį siuntimo formoje pažymima papildoma informacija apie įtarimą dėl karcinomos ir informuojamas GKV PP RC moterį siunčia į ginekologo konsultaciją skubos tvarka.
Moteris, kuriai įtariamas gimdos kaklelio vėžys, siunčiama į ginekologo konsultaciją (atlikti kolposkopijos). Kolposkopija turi būti atlikta per 2 savaites nuo siuntimo.
8.1.13. Ankstesnis displazijos (CIN ir CGIN) gydymas ir „pasveikimo kriterijus“
Po 4 – 6 mėn. galima kartoti citologinį tyrimą, o jei jis neatliktas, 6–9 mėn. ir 18–24 mėn. po gydymo atliekami AR ŽPV ir citologinis tyrimai. Jei bent du tyrimai per 24 mėn. po gydymo pokyčių nerodo (neaptinkama AR ŽPV, o citologinis tyrimas pokyčių nerodo arba nustatoma ne didesnių kaip ASC-US pokyčių), moteriai kviečiama dalyvauti programoje įprasta tvarka. (Pagal ES rekomendacijas po aukšto laipsnio displazijos gydymo moteris stebima patikros tyrimus atliekant kasmet iki 5 metų po gydymo).
Jei ŽPV tyrimo rezultatas teigiamas, o citologiniu tyrimu aptinkama ≥ LSIL pokyčių, atliekama kolposkopija. Po gydymo neaptinkant citologinių pokyčių, bet išliekant infekuotumui AR ŽPV pacientė stebima patikros tyrimus kartojant kasmet.
Po neradikalaus CGIN gydymo, kai moteris pakartotinės ekscizijos atsisakė, PAP testas ir ŽPV tyrimas kartojami 6 mėn. ir 12 mėn. po gydymo, vėliau citologinė patikra iki 10 metų vykdoma kasmet.
8.2. Rekomendacijos, taikytinos histologiškai patvirtinus gimdos kaklelio displaziją (CIN) (ES)
8.2.1. Taktika nustačius LSIL (CIN1)
Daugiau nei 50 proc. LSIL (CIN1) pažaidų regresuoja per 22 mėnesius. Moterys, kurioms histologiškai patvirtinta LSIL (CIN1), gali būti stebimos atliekant kolposkopiją arba citologinį tyrimą arba gydomos tiek abliaciniais, tiek destrukciniais metodais. Stebėjimo intervalas turėtų būti ne trumpesnis nei 12 mėn. Jei pažaida išlieka ilgiau nei 24 mėn., reikėtų aptarti su paciente gydymo galimybes ir būdus.
Tiek stebėti, tiek naudoti abliacinius metodus galima tik esant šioms aplinkybėms:
· matoma visa transformacijos zona (100 proc.);
· nėra liaukų anomalijų požymių (100 proc.);
· nėra invazinės ligos požymių (100 proc.).
Jeigu per kolposkopiją epitelių jungtis nėra visiškai matoma, rekomenduojamas ekscizinis gydymas. Atkryčiams gydyti taip pat rekomenduojama ekscizija.
8.2.2. Taktika nustačius HSIL (CIN2, CIN3) ir CIS
Moterims, kurioms biopsija patvirtinta aukšto laipsnio CIN (CIN2, CIN3, CIS), turi būti gydomos (išimtis – nėščios moterys). Priimtinas lygis > 90,0 proc. pagydytų per 4 sav. nuo diagnozės nustatymo, 100 proc. pagydytų per 8 sav. nuo diagnozės nustatymo pacienčių. Rekomenduojama gydyti eksciziniais būdais, tačiau taip pat galima abliacija, kai kolposkopuojant gerai matoma visa epitelių jungtis (ES rekomendacijos).
8.2.3. Mikroinvazinė karcinoma
Ia1 stadijos mikroinvazinė karcinoma (FIGO) gali būti išgydoma lokaliais eksciziniais metodais, jei:
· ekscizijos kraštuose nėra CIN ir invazinės ligos;
· ginekologinio vėžio centro patologas ir DDK peržiūrėjo histologinius duomenis.
Jei invazinė pažaida pašalinama, bet CIN tęsiasi iki operacinio pjūvio krašto, būtina pakartotinė ekscizija, siekiant patvirtinti operacijos radikalumą ir įsitikinti, jog invazinės ligos nebėra.
Net tais atvejais, kai planuojama histerektomija, pakartotinė ekscizija turėtų būti atliekama siekiant patikrinti, ar nėra invazinės ligos, dėl kurios būtų reikalinga radikali operacija.
8.2.4. Stebėjimas po CIN gydymo
Gimdos kaklelio vėžio išsivystymo rizika moterims, gydytoms dėl CIN, yra nuo dviejų iki penkių kartų didesnė nei bendrai populiacijai. Tyrimai parodė, kad jei ir citologinio, ir ŽPV tyrimo rezultatai praėjus 6 mėn. po gydymo yra neigiami, HSIL (CIN2+) rizika per ateinančius dvejus metus yra mažesnė nei 0,5 proc. Todėl vykdant stebėjimą po gydymo siūloma atlikti AR ŽPV tyrimą ir citologinį tyrimą praėjus 6–9 mėn. ir 18–24 mėn. po gydymo.
Įtakos stebėjimo dažnumui ir trukmei gali turėti šie veiksniai:
2) pažaidos tipas: po gydymo dėl liaukinės displazijos reikia atidžiai įvertinti endocervikalinį kanalą, dažniausiai naudojant endocervikalinį šepetėlį tyrimo mėginiui paimti;
4) rezekcinių kraštų histologija (įtarimas dėl neradikalaus displazijos pašalinimo).
Jei bent du tyrimai per 24 mėn. po gydymo pokyčių nerodo (neaptinkama AR ŽPV, o citologinis tyrimas pokyčių nerodo arba rodo ne didesnius kaip ASC-US), moteris toliau kviečiama dalyvauti patikros programoje įprasta tvarka, priimtinas lygis > 95 proc.
24 mėn. po gydymo displazijos aptikimas turi būti retas; priimtinas lygis < 5 proc.
Jei ŽPV tyrimo rezultatas teigiamas, o citologiniu tyrimu aptinkama ≥ LSIL pokyčių, atliekama kolposkopija. Po gydymo citologinių pokyčių neaptinkant, bet išliekant infekuotumui AR ŽPV pacientė stebima patikros tyrimus kartojant kasmet.
Po neradikalaus CGIN gydymo, kai moteris pakartotinės ekscizijos atsisakė, PAP testas ir ŽPV tyrimas kartojami praėjus 6 mėn. ir 12 mėn. po gydymo, vėliau citologinė patikra iki 10 metų vykdoma kasmet.
8.2.5. Gydymo radikalumo svarba. Taktika po neradikalaus gydymo
Nors operacinio gydymo neradikalumas didina displazijos atkryčio riziką, pakartotinė ekscizija nėra būtina esant šioms aplinkybėms:
· neaptinkama liaukinio epitelio displazijos požymių;
· nėra invazinės ligos požymių;
· moteris jaunesnė nei 50 metų.
AR ŽPV tyrimas yra gerokai jautresnis vertinant pasveikimą ar prognozuojant ligos atkryčio riziką.
Jei vyresnėms nei 50 metų amžiaus moterims po neradikalaus gydymo dėl aukšto laipsnio pokyčių nėra galimybės užtikrinti citologinės, kolposkopinės patikros ir AR ŽPV tyrimų, reikėtų pakartotinai atlikti eksciziją arba totalinę histerektomiją, siekiant išlaikyti histologiškai švarius operacinius kraštus (100 proc.).
Jei pakartotinė gimdos kaklelio ekscizija yra neradikali, būtina pakartotinių tyrimų mėginius imti endocervikaliniu šepetėliu giliai iš kaklelio kanalo. Jei tokio stebėjimo sąlygų nėra, rekomenduojamas pakartotinis operacinis gydymas. Operacijos apimtis priklauso nuo moters amžiaus ir reprodukcinių planų.
8.3. Kitos klinikinės situacijos
8.3.1. Nėščios moterys
Nėščios moters, kuriai anksčiau nėra diagnozuota gimdos kaklelio pokyčių, patikros tyrimas turėtų būti atidedamas. Jeigu paskutinis gimdos kaklelio patikros tyrimas atliktas daugiau nei prieš 5 metus, moteriai net ir nėštumo metu tyrimo mėginys turėtų būti imamas. Jei moteris buvo pakviesta į įprastinį patikrinimą ir yra nėščia, tepinėlio ėmimas paprastai atidedamas. Jei ankstesnis tepinėlis buvo nenormalus ir tuo tarpu moteris pastojo, tolesnių veiksmų atidėti nereikėtų.
Nėštumo metu biopsija atliekama tik įtariant invazinį vėžį. Invazinio vėžio neįtariant, vertinimas dėl displazijos nukeliamas: įtariant žemo laipsnio displaziją šis vertinimas atliekamas trys mėnesiai po gimdymo, įtariant aukšto laipsnio displaziją – antro nėštumo trimestro pabaigoje (100 proc.). Tokios pacientės turi būti konsultuojamos perinataliniuose centruose.
Įtariant invazinį vėžį, rekomenduojama kylinė ar kilpinė ekscizija nėštumo metu. Tikslinė taškinė biopsija, kurios metu aptinkama tik CIN, invazinės ligos visiškai atmesti neleidžia.
8.3.2. Taktika diagnozavus CIN po menopauzės
Citologinių pokyčių ir teigiamo ŽPV tyrimo rezultato dažnis moterims po menopauzės yra mažas, jeigu iki tol patikros rezultatai buvo normalūs. Nėra įrodymų, kad sisteminė pakaitinė hormonų terapija menopausės metu turėtų įtakos gimdos kaklelio vėžio rizikai, tačiau žinoma, kad vietinių estrogenų vartojimas pagerina kolposkopijos ir citologinio tyrimo sąlygas.
8.3.3. Taktika po histerektomijos, kai anksčiau buvo aptikta CIN
Moterims, kurioms atlikus histerektomiją gimdos kaklelyje aptikta displazija, yra rizika susirgti makšties intraepiteline neoplazija ir vėžiu.
Po histerektomijos, kai aptikta CIN pašalinta radikaliai: jei AR ŽPV tyrimo rezultatas 6–9 mėn. ir 18–24 mėn. neigiamas, tolesnė patikra nereikalinga; priimtinas lygis > 95 proc.
Po histerektomijos, kai aptikta CIN pašalinta neradikaliai: tolesnė patikra – makšties citologinis tyrimas ir ŽPV tyrimas po 6–9 mėn. ir 18–24 mėn. Jei patikros tyrimai pokyčių nerodo, toliau patikra atliekama įprasta tvarka iki patikros pabaigos (60 m.).
8.3.4. Pacientės, kurioms taikomas imunosupresinis gydymas
Pacientės, kurios taikomas imunosupresinis gydymas, stebimos pagal bendrus nacionalinius patikros algoritmus.
Visos 25–60 metų moterys, ruošiamos organų transplantacijai, turi būti patikrintos dėl ikivėžinių gimdos kaklelio ligų ne vėliau kaip 1 metai iki planuojamos operacijos. Aptikta CIN turi būti gydoma.
8.3.5. ŽIV infekuotos moterys
Gimdos kaklelio displazijų paplitimas tarp moterų, kurioms serologiniu tyrimu ŽIV nenustatyta, yra maždaug 3 proc., o tarp ŽIV infekuotų moterų pokyčių dažnis siekia 20–40 proc.
Diagnozavus ŽIV infekciją, atliekamas ir citologinis tyrimas, ir kolposkopija, Vėliau, jei yra galimybė, citologinis tyrimas atliekamas kartą per metus. Taktika aptikus pokyčių turėtų atitikti nacionalines gaires, kaip ir moterims, kurioms ŽIV nenustatytas.
8.3.6. Taktika esant citologinio tyrimo ir kolposkopijos (histologinio tyrimo) rezultatų neatitikimų
Idealiu atveju visos situacijos, kai aptinkamas neatitikimas tarp citologinio tyrimo, kolposkopijos ir (arba) histologinių tyrimų rezultatų, siekiant optimizuoti gydymą turėtų būti aptariamos daugiadalykiame konsiliume.
Kai citologiniu tyrimu nustatoma žymių pokyčių, o per kolposkopiją displazijos nepastebima, patikros tyrimai turėtų būti kartojami ir peržiūrimas pirminis citologinis tyrimas. Pokyčiams išliekant, kartojamas citologinis tyrimas, užtikrinant maksimaliai kokybiškas tyrimo sąlygas – pagydžius uždegimą ar pakoregavus atrofinę būklę po menopauzės. Ypač svarbu apžiūrėti epitelių jungtį. Jei epitelių jungtis matoma ir per kolposkopiją pokyčių nepastebima, reikėtų nuodugniai ištirti makštį. Neaptikus pokyčių makštyje, ypatingas dėmesys skiriamas gimdos kaklelio kanalui. Neaptikus pokyčių nei gimdos kaklelyje, nei makštyje ar nuodugniai negalint įvertinti epitelių jungties, šalinama TZ, taip pat šalinamas apatinis gimdos kaklelio kanalo trečdalis, po to atliekamas endocervikalinis kiuretažas (ECC).
8.3.7. Negydytų moterų stebėjimas
· Aptikus aukšto laipsnio citologinių pokyčių, 95 proc. atvejų atliekama biopsija. Jei gydymas netaikomas, stebėjimas vykdomas kas 6 mėn., atliekant citologinį tyrimą ir kolposkopiją. Žymiems citologiniams pokyčiams išliekant, atliekama kolposkopija ir biopsija, patvirtinus žymius pokyčius, rekomenduojamas ekscizinis gydymas (90 proc.).
· Aptikus aukšto laipsnio citologinių pokyčių, bet kolposkopiniu tyrimu įtariant žemo laipsnio pažaidą, kai kolposkopinis tyrimas tinkamas (epitelių jungtis visiškai matoma), atliekamos daugybinės biopsijos (90 proc.) arba visos srities eksciziją. Jei patvirtinama žemo laipsnio pakitimai ar intraepitelinių pakitimų neaptinkama, rekomenduojamas stebėjimas kartojant citologinį tyrimą ir kolposkopiją po 6 mėn.
· Aptikus AR ŽPV, kai citologiniu tyrimu nustatyti pokyčiai žemo laipsnio ir per kolposkopiją displazijos nepastebima, vykdoma kontrolė po 1 metų.
· Aptikus AR ŽPV, kai citologiniai pokyčiai žemo laipsnio, o per pakartotinį tyrimą ŽPV neaptikta, moteris grąžinama į patikros programą; priimtinas lygis > 90 proc.
· Nėščioms moterims biopsija ir gydymas atidedami, iki pagimdys, išskyrus atvejus, kai įtariamas invazinis vėžys; priimtinas lygis > 80 proc.
· Per kolposkopiją nėščiai moteriai įtariant žemo laipsnio displaziją, pakartotinė kolposkopija atliekama ne anksčiau kaip 3 mėn. po gimdymo; priimtinas lygis > 95 proc.
· Per kolposkopiją nėščiai moteriai įtariant aukšto laipsnio displaziją, pakartotinė kolposkopija atliekama antro nėštumo trimestro pabaigoje ir 3 mėnesiai po gimdymo; priimtinas lygis > 95 proc.
· Per kolposkopiją nėščiai moteriai įtariant invaziją, turi būti atliekama kylinė ar kilpinė, bet ne taškinė biopsija; priimtinas lygis 100 proc.
8.4. Komunikacija su moterimis (informacijos pateikimas)
Apie biopsijos rezultatus ir tolesnę taktiką moteris informuojama per 4 savaites nuo tyrimo datos. Už tai atsakinga klinika, kurioje atlikta kolposkopija ir biopsija. Informacija gali būti pateikiama telefonu, per nuotolinę ar kontaktinę konsultaciją.
8.5. Kokybės reikalavimai ir standartai
8.5.1. Personalo kvalifikacijos reikalavimai
Žiūrėti VII skyriaus „Personalo kvalifikacijos reikalavimai“.
8.5.2. Reikalingų duomenų registravimas, protokolai
Žiūrėti VII skyriaus „Reikalingų duomenų registravimas, protokolai“.
Negydytų moterų stebėjimas (rodikliai nebūtini):
· Aptikus AR ŽPV, kai citologiniai pokyčiai žemo laipsnio, o pakartotiniu tyrimu ŽPV neaptikus, moteris grąžinama į patikros programą; priimtinas lygis > 90 proc.
· Nėščioms moterims biopsija ir gydymas atidedami, iki pagimdys, išskyrus atvejus, kai įtariamas invazinis vėžys; priimtinas lygis > 80 proc.
· Per kolposkopiją nėščiai moteriai įtarus žemo laipsnio displaziją, pakartotinė kolposkopija atliekama ne anksčiau kaip 3 mėn. po gimdymo; priimtinas lygis > 95 proc.
· Per kolposkopiją nėščiai moteriai įtarus aukšto laipsnio displaziją, pakartotinė kolposkopija atliekama antro nėštumo trimestro pabaigoje ir 3 mėnesiai po gimdymo; priimtinas lygis > 95 proc.
· Per kolposkopiją nėščiai moteriai įtarus invazinį vėžį, atliekama kylinė ar kilpinė, bet ne taškinė biopsija; priimtinas lygis 100 proc.
IX SKYRIUS. HISTOLOGINIU TYRIMU PATVIRTINTŲ POKYČIŲ CHIRURGINIS GYDYMAS
9.1. Įžanga
Histologiniu tyrimu patvirtintų gimdos kaklelio pokyčių chirurginio gydymo metodai skirstomi į destrukcinius (krioterapija, vaporizacija lazeriu, šaltoji koaguliacija) ir ekscizinius (išpjovimas skalpeliu, išpjovimas elektros kilpa, išpjovimas lazeriu, histerektomija).
Atlikti tyrimai nurodo, kad nė vienas iš išvardytų metodų nėra reikšmingai geresnis, lyginant gydymo sėkmę ar patiriamas komplikacijas.
Daugeliu atvejų pirmenybė teikiama eksciziniams gydymo metodams, nes jie, skirtingai nuo destrukcinių, leidžia histologiškai įvertinti pašalintos transformacijos zonos dalies pokyčius, jų plotį ir gylį, atpažinti arba paneigti mikroinvazinį vėžį, gimdos kaklelio kanalo liaukinio epitelio pokyčius.
9.2. Organizaciniai reikalavimai
Licencija
Gimdos kaklelio chirurginis gydymas atliekamas įstaigose, kurios pagal galiojančius teisės aktus turi licenciją teikti šias paslaugas.
Moterų informavimas apie nustatytus tyrimų rezultatus (tyrimų atsakymai)
Per 14 darbo dienų atsakymai apie operacijos metu pašalintuose gimdos kaklelio mėginiuose nustatytus pokyčius ir kitus radinius išsiunčiami paštu ir įkeliami į ESPBI IS posistemę, prie kurios pacientė gali prisijungti su asmeniniais prieigos duomenimis.
9.3. Patalpoms taikomi reikalavimai
Patalpos ir baldai turi atitikti Lietuvos Respublikos higienos normas. Operacinės turi būti aprūpintos tinkama įranga.
Minimalūs reikalavimai atitinka keliamus patalpai, kurioje atliekamas kolposkopinis tyrimas. Operacinių įrengimas turi atitikti teisės aktuose statytus darbuotojų sveikatos ir saugos reikalavimus.
9.4. Personalo kvalifikacijos reikalavimai
Gydymo procedūras gali atlikti tik asmenys, turinys galiojančią gydytojo akušerio-ginekologo licenciją.
Jei gydymui naudojama įranga, reikalaujanti specifinių žinių ar įgūdžių, prieš pradėdamas ja naudotis medicininis personalas turi šių žinių ir įgūdžių įgyti pagal įrangos gamintojo pateiktas rekomendacijas ir galiojančias įstaigos vidaus darbo taisykles.
9.5. Naudojamai įrangai taikomi reikalavimai
Būtina įranga:
· ginekologinei apžiūrai tinkama kėdė (pageidautina, reguliuojamo aukščio ir padėčių);
· šviesos šaltinis, tinkamas gimdos kakleliui apšviesti;
· sterilios pirštinės;
· makšties plėtiklis (pageidautina, su dūmų ištraukimo jungtimi);
· šoninis makšties plėtiklis;
· Luerio spaustukas;
· endocervikalinė kiuretė;
· endocervikalinis šepetėlis;
· 2 viendantės žnyplės;
· tamponėliai;
· tirpalai:
· NaCl 0,9 proc.,
· acto rūgšties 3-5 proc.,
· liugolio tirpalas;
· adatos laikiklis;
· besirezorbuojantis siūlas;
· 5 ml švirkštas su adata;
· vietinis anestetikas (1 ar 2 proc. lidokainas);
· adrenalino tirpalas 1:100 000.
Speciali įranga – išvardyta aprašant kiekvieną gydymo metodą.
Rekomenduojama įranga – kolposkopas.
9.6. Chirurginių metodų apžvalga
9.6.1. Destrukciniai gydymo metodai
Vietinės destruktyviosios terapijos tikslas yra sunaikinti intraepitelinės neoplazijos plotus. Kadangi histologinis tyrimas neatliekamas, kyla pavojus tinkamai neįvertinti ligos tipo ir išplitimo, taigi taikomas gydymas gali būti nepakankamas. Kad šie metodai būtų saugūs ir veiksmingi, pacientės turi atitikti šiuos atrankos kriterijus:
· matoma visa transformacijos zona;
· nėra įtariama liaukinio epitelio pokyčių;
· neįtariama piktybinės ligos invazija;
· histologiškai patvirtinta CIN (nepakanka tik citologinių pokyčių);
· tarpusavyje koreliuojantys citologinių ir histologinių tyrimų atsakymai;
· tik išimtiniais atvejais šie metodai taikomi vyresnėms nei 50 m. moterims;
· turi būti galimas tinkamas tolesnis stebėjimas;
· destrukcine terapija turėtų būti siekiama sunaikinti visą transformacijos zoną, nes dėl labiau lokalizuoto gydymo gresia ligos recidyvavimas.
9.6.1.1. Krioterapija
Tai gydymo metodas, kuomet šalčiu sukeliama gimdos kaklelio transformacijos zonos audinių nekrozė.
Speciali įranga. Dujų (azoto monoksido (N2O) ar anglies dvideginio (CO2)) rezervuaras, slėgio reguliatorius, antgalio rankena, keli skirtingo skersmens (dažniausiai 19 mm) ir formos (plokšti ar kūginiai) antgaliai.
Anestezija. Nereikalinga.
Procedūra
· Pacientė pasiruošia ginekologinei apžiūrai.
· Makšties skėtikliu vizualizuojamas gimdos kaklelis, įvertinamas tinkamumas krioterapijai.
· Gimdos kaklelis išvalomas 0,9 proc. NaCl tirpalu suvilgytu tamponu.
· Gimdos kaklelis suvilgomas 3–5 proc. acto rūgšties tirpalu, kad išryškėtų displazijos plotų ribos.
· Krioterapinis antgalis suvilgomas 0,9 proc. NaCl tirpalu.
· Krioterapinis antgalis priglaudžiamas prie gimdos kaklelio, kad kanalo anga būtų centre. Jei displazijos plotas yra neuždengiamas antgalio > 2 mm, procedūra nepradedama, pasirenkamas kitas antgalis, o tinkamo antgalio neturint – kitas gydymo metodas.
· Dažniausiai taikoma 2 šaldymo ciklų procedūra: 3 min. šaldymo, 5 min. atitirpimo, 3 min. šaldymo. Adekvačią procedūros trukmę nurodo 4–5 mm šerkšno žiedas apie antgalį.
· Baigus procedūrą, antgalis nuo gimdos kaklelio atitraukiamas tik kai audiniai visiškai atitirpsta.
· Apžiūrimas gimdos kaklelis, makštis netamponuojama, ištraukiamas skėtiklis.
9.6.1.2. Šaltoji koaguliacija
Tai gydymo metodas, kai transformacijos zonos audiniai koaguliuojami iki 100 °C įkaitintu antgaliu.
Speciali įranga. Semm koaguliatorius, antgalio rankena, keli skirtingo skersmens ir formos (plokšti ar kūginiai) antgaliai.
Anestezija. Nebūtina. Kai kuriais atvejais gali būti taikoma vietinė analgezija, paracervikalinė blokada.
Procedūra
· Pacientė pasiruošia ginekologinei apžiūrai.
· Makšties skėtikliu vizualizuojamas gimdos kaklelis, įvertinamas tinkamumas terapijai.
· Gimdos kaklelis išvalomas 0,9 proc. NaCl tirpalu suvilgytu tamponu.
· Gimdos kaklelis suvilgomas 3–5 proc. acto rūgšties tirpalu, kad išryškėtų displazijos plotų ribos.
· Iki 100 °C įkaitintas antgalis 20 sekundžių priglaudžiamas prie displazijos ploto. Procedūra gali būti kartojama, priglaudžiant antgalį 20 sekundžių prie kito ploto, tačiau bendra procedūros trukmė neturėtų viršyti 2 min.
· Baigus procedūrą apžiūrimas gimdos kaklelis, makštis netamponuojama, ištraukiamas skėtiklis.
9.6.1.3. Vaporizacija lazeriu
Speciali įranga. Su kolposkopu sujungtas CO2 lazeris.
Anestezija. Nebūtina. Kai kuriais atvejais gali būti taikoma vietinė analgezija, paracervikalinė blokada.
Procedūra
· Pacientė pasiruošia ginekologinei apžiūrai.
· Makšties skėtikliu vizualizuojamas gimdos kaklelis, įvertinamas tinkamumas vaporizacijai lazeriu.
· Gimdos kaklelis išvalomas 0,9 proc. NaCl tirpalu suvilgytu tamponu.
· Gimdos kaklelis suvilgomas 3–5 proc. acto rūgšties tirpalu, kad išryškėtų displazijos plotų ribos.
· Kolposkopu įvertinamas displazijos plotas.
· Rekomenduojamas lazerio spindulio plotas 2–2,5 mm, galia 25–40 W.
· Displazijos ploto kontūras pažymimas koaguliuojant 2 mm lazerio spinduliu 2–3 mm toliau išorinės displazijos ploto ribos.
· Atliekama visos transformacijos zonos vaporizacija iki 6–8 mm gylio. Gimdos kaklelio centre rekomenduojama papildoma 4–8 mm gylio vaporizacija.
· Jei displazijos plotas pereina į makšties gleivinę, vaporizacijos gylis turi neviršyti 1,5 mm.
· Baigus procedūrą apžiūrimas gimdos kaklelis, makštis netamponuojama, ištraukiamas skėtiklis.
9.6.2. Eksciziniai gydymo metodai
Ekscizinio gydymo tikslas – pašalinti visą pažaidą ir ją pateikti histologiniam įvertinimui atlikti. Transformacijos zonos ekscizija neturėtų būti atliekama LSIL (CIN1) atveju, nebent pažaida buvo stebima ilgiau nei metus. Ekscizija atliekama nedelsiant, jei yra aukšto laipsnio intraepitelinė neoplazija arba įtariama ankstyvoji stromos invazija ar mikroinvazija.
Bet kuriuo metodu atliekant eksciziją, reikia laikytis šių rekomendacijų:
· Pageidautina, kad procedūra būtų atliekama ją stebint kolposkopu. Nesant tokios galimybės, kolposkopinis tyrimas patyrusio kolposkopuotojo (pageidautina, operaciją atliksiančio gydytojo) turi būti atliktas ir aprašytas prieš procedūrą. Planuojamo išpjauti mėginio dydis ir forma nustatomi pagal kolposkopinį pažaidos vaizdą. Pažaida pašalinama kartu su visa transformacijos zona.
· Pageidautina, kad pažaida būtų pašalinta vienu fragmentu. Transformacijos zonos ekscizija keliais fragmentais gali apsunkinti histopatologinį operacijos radikalumo vertinimą. Be to, jei yra mikroinvazinė liga, gali būti neįmanoma tiksliai nustatyti ligos stadiją.
· Epitelio pokyčiai, esantys šone nuo centrinės srities, gali būti šalinami atskirai.
· Rekomenduojama pažymėti išpjautą mėginį siūlu ties 12 valanda, kad histopatologui būtų lengviau orientuoti mėginį.
· Chirurgas turėtų vengti terminio ar mechaninio ektocervikalinio epitelio ar endocervikalinio kanalo pažeidimo.
· Jei pažaida susijusi su endocervikaliniu kanalu, po ekscizijos reikia paimti gimdos kaklelio kanalo mėginius atliekant endocervikalinį kiuretažą. Endocervikalinio kiuretažo tikslas yra aptikti endocervikalinę plokščiojo ar liaukinio epitelio pažaidą, kurios neįmanoma pasiekti atliekant kolposkopinę biopsiją.
· Endocervikalinio kanalo kiuretažas gali būti pakeičiamas mėginio ėmimu endocervikaliniu šepetėliu. Kai kurie tyrimai nurodo, kad šio metodo klaidingai neigiamų atsakymų dažnumas yra mažesnis.
· Endocervikalinis kiuretažas neturėtų būti atliekamas nėštumo metu.
9.6.2.1. Išpjovimas elektros kilpa
Speciali įranga. Medicininis elektros generatorius, elektros peilio rankena, skirtingų formų ir dydžių elektros peiliai (dažniausiai naudojamos 10 x 8 mm ir 10 x 4 mm kilpos, 20 x 8 mm, 20 x 15 mm ir 10 x 10 mm trikampiai elektrodai, 3 mm ir 5 mm rutuliniai elektrodai, adatinis elektrodas).
Anestezija. Rekomenduojama vietinė anestezija. Galima paracervikalinė blokada, bendrinė anestezija.
Procedūra
· Pacientė pasiruošia ginekologinei apžiūrai.
· Patikrinama įranga, kuo arčiau pacientės dubens (prie šlaunies, po juosmeniu) pritvirtinamas elektros generatoriaus grįžtamasis elektrodas.
· Makšties skėtikliu vizualizuojamas gimdos kaklelis.
· Gimdos kaklelis išvalomas 0,9 proc. NaCl tirpalu suvilgytu tamponu.
· Gimdos kaklelis suvilgomas 3-5 proc. acto rūgšties tirpalu, kad išryškėtų displazijos plotų ribos.
· Jei yra galimybė, kolposkopu įvertinamas displazijos plotas.
· Gimdos kaklelis patepamas liugolio tirpalu.
· Pasirenkamas tinkamo dydžio ir formos elektrodas, kad šalinamas gimdos kaklelio mėginys, jei įmanoma, būtų pašalintas vienu pjūviu.
· Elektros generatoriuje pasirenkamas tinkamas srovės tipas („blended“) ir galia (trikampiams elektrodams ir 10 mm kilpoms 32–38 W, 20 mm kilpoms – 40–48 W).
· Aktyvavus pjovimo režimą pašalinama pasirinkta gimdos kaklelio dalis. Naudojant kilpos formos elektrodą gylis turi būti nuo 7 mm iki 12 mm, į plotį pašalinta dalis 3–5 mm platesnė nei matoma displazijos paveikto epitelio riba. Esant būtinybei gali būti atliekami keli pjūviai, atskirai išpjaunamas gilesnis kūgis apie gimdos kaklelio kanalą.
· Pašalinti audiniai paruošiami siųsti atlikti histologinio tyrimo, pažymint mėginį, kad būtų galima identifikuoti kvadrantus.
· Naudotas aktyvus elektrodas pakeičiamas į 3 mm ar 5 mm rutulinį elektrodą. Pakeičiamos elektros generatoriaus nuostatos (rekomenduojama galia 3 mm elektrodui 30 W, 5 mm – 35 W, režimas – „Fulgurate“ arba „Spray“).
· Atliekama kraujuojančių žaizdos vietų koaguliacija.
· Jei pažaida susijusi su endocervikaliniu kanalu, atliekamas endocervikalinis kiuretažas arba mėginys paimamas endocervikaliniu šepetėliu.
· Baigus procedūrą apžiūrimas gimdos kaklelis, makštis tamponuojama išimtiniais atvejais, ištraukiamas skėtiklis.
9.6.2.2. Išpjovimas skalpeliu
Speciali įranga. Standartinis operacijų, atliekamų per makštį, chirurginis rinkinys.
Anestezija. Procedūra atliekama operacinėje, taikant regioninę ar bendrinę nejautrą.
Procedūra
· Pacientė paguldoma ant operacinio stalo litotominėje padėtyje.
· Makšties skėtikliu vizualizuojamas gimdos kaklelis.
· Gimdos kaklelis suvilgomas 3-5 proc. acto rūgšties tirpalu ir (arba) liugolio tirpalu, kad būtų vizualizuojamas displazijos paveiktas epitelis.
· Siekiant sumažinti netenkamo kraujo kiekį, į gimdos kaklelio stromą gali būti sušvirkščiama vazokonstriktorių tirpalo, apsiuvamos gimdos kaklelio kraujagyslės.
· Skalpeliu išpjaunamas gimdos kaklelio kūgis, atliekama hemostazė apsiuvant ar koaguliuojant kraujagyslių šakas.
· Pašalinti audiniai paruošiami išsiųsti atlikti histologinio tyrimo.
· Baigus procedūrą apžiūrimas gimdos kaklelis, makštis gali būti tamponuojama, ištraukiamas skėtiklis.
9.6.2.3. Histerektomija
Speciali įranga. Standartinis chirurginis rinkinys, priklausomai nuo pasirinkto operacijos tipo.
Anestezija. Procedūra atliekama operacinėje, taikant regioninę ar bendrinę nejautrą.
Procedūra
· Rekomenduojama ekstrafascijinė histerektomija.
· Operacijos būdas (vagininis, laparotominis, laparoskopinis) pasirenkamas individualiai.
Literatūros sąrašas:
1. Everatt R, Intaitė B. Trends in cervical cancer mortality rates in Lithuania, 1987-2016. Cancer Epidemiology 2018; 57:85-89
2. Everatt R, Kuzmickienė I, Intaitė B, Anttila A. Effectiveness of the cervical cancer prevention programme: a case-control mortality audit in Lithuania. Eur J Cancer Prev 2020; 29:504-510
3. Anttila A, Arbyn M, De Vuyst H, Dillner J, Dillner L, Franceschi S et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. 2015 2nd ed-suppl, Luxembourg: Publications Office of the European Union
4. Arbyn M, Anttila A, Jordan J, Ronco G, Schenck U, Segnan N et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. 2008 2nd ed, Luxembourg: Publications Office of the European Union
5. Meijer C, Berkhof J, Castle PE, Hesselink AT, Franco EL, Ronco G et al. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer 2009; 124:516-520
6. Arbyn M, Snijders PJF, Meiler C, Berkhof J, Cuschieri K, Kocjan B et al. Which high-risk HPV assays fulfil criteria for use in primary cervical cancer screening? Clin Microbiol Infect 2015; 21:817-826
7. Maver PJ, Poljak M. Primary HPV-based cervical cancer screening in Europe: implementation status, challenges, and future plans. Clin Microbiol Infect 2020; 26:579-583
8. Dijkstra MG, Niekerk D, Rijkaart DC, Kemenade FJ, Heideman D, Snijders P et al. Primary hrHPV DNA testing in cervical cancer screening: how to manage screen-positive women? A POBASCAM trial substudy. Cancer Epidemiol Biomarkers Prev 2013; 23(1): 55–63
9. Klein A, Velzen R. Policy Framework for Population Screening for Cancer. 2018-0042, The Netherlands: National Institute for Public Health and the Environment
10. Smith JHF, Patnick J, Blanks RG, Denton KJ, Desai MS, Mehew SW et al. Achievable standards, Benchmarks for reporting, and Criteria for evaluating cervical cytopathology. 2013 3rd ed, United Kingdom: NHS Cancer Screening Programmes
11. Veen N. Framework for the Execution of Cervical Cancer Population Sreening. 2017, The Netherlands: National Institute for Public Health and the Environment
12. Briggs P, Cross P, Dudding N, Hewer E, May S, Smith P. A Guide for Laboratories Participating in the NHS Cervical Screening Programme. 2003 Publication No 14, United Kingdom: NHS Cancer Screening Programmes
13. Kelly S, Davin-Power M, Downey P, Flannelly G, Freeman-Wang T, Gleeson J et al. Guidelines for Quality Assurance in Cervical Screening. 2nd ed, Ireland: National Cancer Screening Service
14. Polman NJ, Snijders P, Kenter GG, Berkhof J, Meijer C. HPV-based cervical screening: Rationale, expectations and future perspectives of the new Dutch screening programme. Prev Med 2019; 119:108-117
15. NHS Executive. Guidance: NHS Cervical Screening Programme: laboratory quality control and assurance for human papiloma testing, July 2019. Available from:
https://www.gov.uk/government/publications/cervical-screening-laboratory-testing-for-human-papillomavirus/nhs-cervical-screening-programme-laboratory-quality-control-and-assurance-for-human-papillomavirus-testing
16. NHS Executive. Guidance: Cervical Screening: acceptable HPV test, June 2019. Available from: https://www.gov.uk/government/publications/cervical-screening-acceptable-hpv-tests/cervical-screening-acceptable-hpv-tests
17. NHS Executive. Guidance: National invasive cervical cancer audit, September 2019. Available from: https://www.gov.uk/government/publications/cervical-screening-auditing-procedures/national-invasive-cervical-cancer-audit
18. RIMV Committed to health and sustainability. Cervical cancer screening programme, December 2011. Available from: https://www.rivm.nl/en/cervical-cancer-screening-programme
19. The Council of the European Union. Council recommendation of 2 December 2003 on cancer screening (2003/878/EC), 2003. Available from: https://ec.europa.eu/jrc/sites/jrcsh/files/2_December_2003%20cancer%20screening.pdf
20. Ponti A, Anttila A, Ronco G, Senore C, Basu P, Segnan N et al. Cancer Screening in the European Union: Report on the implementation of the Council Recommendation on cancer screening. 2017, France: International Agency for Research on Cancer
21. Májek O, Anttila A, Arbyn M, van Veen EB, Engesæter B, Lönnberg S. The legal framework for European cervical cancer screening programmes. Eur J Public Health 2019; 29: 345-350
22. Dijkstra MG, Snijders PJ, Arbyn M, Rijkaart DC, Berkhof J, Meijer CJ. Cervical cancer screening: on the way to a shift from cytology to full molecular screening. Ann Oncol 2014;25(5):927-35
23. Dijkstra MG, van Zummeren M, Rozendaal L, van Kemenade FJ, Helmerhorst TJ, Snijders PJ et al. Safety of extending screening intervals beyond five years in cervical screening programmes with testing for high risk human papillomavirus: 14 year follow-up of population based randomised cohort in the Netherlands. BMJ 2016; 355: i4924
24. Ronco G, Dillner J, Elfström KM, Tunesi S, Snijders PJ, Arbyn M et al. International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 2014; 383(9916): 524-32
25. Ronco G, Giorgi Rossi P. Role of HPV DNA testing in modern gynaecological practice. Best Pract Res Clin Obstet Gynaecol 2018; 47: 107-118
27. LR SAM 2004 m. birželio 30 d. įsakymas Nr. V-482 „Dėl Gimdos kaklelio piktybinių navikų prevencinių priemonių, apmokamų iš PSDF biudžeto lėšų, finansavimo programos patvirtinimo“. Prieiga: https://www.e-tar.lt/portal/lt/legalAct/TAR.8FD6BCF64FD4
28. LR SAM 2012 m. sausio 12 d. įsakymas Nr. V-17 „Dėl Klinikinių laboratorinių tyrimų kokybės gerinimo programos patvirtinimo“. Prieiga: https://e-seimas.lrs.lt/portal/legalAct/lt/TAD/ TAIS.417365/asr